
【题目】工业生产中容易产生有害的含铬工业废水和含氰废水,严重威胁人类的健康和安全.图1是处理工业含铬废水和含氰废水的工艺流程. 
已知:含铬废水中铬的存在形式为Cr2O72﹣ , Cr元素常见的化合价+3、+6,含氰废水中有CN﹣存在.
请回答下列问题:
(1)含氰废水中有CN﹣存在,其中C元素的化合价为 .
的代数式表示)
(2)向含铬废水中加下列哪种物质将pH调整到2~3,(填字母).
a.稀盐酸 b.稀硫酸 c.稀硝酸
的代数式表示)
(3)pH>10时,图中反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,请写出反应的离子方程式 .
的代数式表示)
(4)经过图中反应Ⅰ和图中反应Ⅱ后,将两种废水混合的目的是
的代数式表示)
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72﹣的废水,原理示意图如图2: 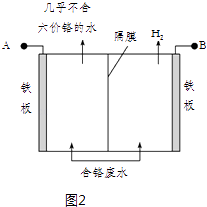
阳极区域溶液中发生反应的离子方程式为 . 若不考虑气体的溶解,当收集到H2 13.44L(标准状况)时,被还原的Cr2O72﹣物质的量为 . 为了使Cr3+和Fe3+转化为Fe (OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则溶液中c (Cr3+)=molL﹣1 . (已知:Ksp[Fe (OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
的代数式表示)
(6)在25℃下,将a molL﹣1 NaCN溶液与0.01molL﹣1盐酸等体积混合(忽略溶液体积变化),反应后测得溶液pH=7,HCN的电离常数Ka为 . (用含a的代数式表示)
【答案】
(1)+2
(2)b
(3)2CN﹣+5ClO﹣+2OH﹣═2CO32﹣+N2↑+5Cl﹣+H2O
(4)使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应
(5)Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O;0.1mol;3×10﹣5
(6)(100a﹣1)×10﹣7
【解析】解:(1)N元素表现﹣3价,元素化合价代数和等于离子所带电荷,可知C元素化合价为+2,所以答案是:+2;(2)含铬废水中铬的存在形式为Cr2O72﹣ , 调节pH转化为CrO42﹣ , 再用亚硫酸钠将其还原为Cr3+ , 硝酸具有强氧化性,可以氧化亚硫酸钠,而加入盐酸易被氧化为氯气,需要用硫酸调节pH,
所以答案是:b;(3)pH>10时,反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,NaClO将CN﹣氧化为碳酸根和氮气,反应离子方程式为:2CN﹣+5ClO﹣+2OH﹣═2CO32﹣+N2↑+5Cl﹣+H2O,
所以答案是:2CN﹣+5ClO﹣+2OH﹣═2CO32﹣+N2↑+5Cl﹣+H2O;(4)两个反应中过量的氧化剂和还原剂反应;发生中和反应(或者可减少后续加入NaOH的量);混合后pH增大,反应Ⅰ中的Cr3+可能生成Cr(OH)3沉淀可减少后续加入NaOH的量,
所以答案是:使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应;(5)右室生成氢气,为阴极室,左室为阳极室,Fe放电生成亚铁离子将Cr2O72﹣还原为Cr3+ , Fe2+被氧化为Fe3+ , 阳极区发生的离子方程式:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,
生成氢气物质的量为 ![]() =0.6mol,根据电子转移守恒,亚铁离子物质的量为0.6mol,再根据离子方程式,可知被还原的Cr2O72﹣物质的量为0.6mol×
=0.6mol,根据电子转移守恒,亚铁离子物质的量为0.6mol,再根据离子方程式,可知被还原的Cr2O72﹣物质的量为0.6mol× ![]() =0.1mol;
=0.1mol;
溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , Ksp[Fe (OH)3]=c(Fe3+)×c3(OH﹣)=4.0×10﹣38 , Ksp[Cr(OH)3]=c(Cr3+)×c3(OH﹣)=6.0×10﹣31 , 联立可得c (Cr3+)=3×10﹣5 molL﹣1 ,
所以答案是:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O;0.1mol;3×10﹣5;(6)混合后溶液中pH=7,可知c(H+)=c(OH﹣)=10﹣7 molL﹣1 , 由电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(CN﹣)+c(Cl﹣),混合后溶液中c(CN﹣)=c(Na+)﹣c(Cl﹣)=(0.5a﹣0.005)mol/L,根据物料守恒c(CN﹣)+c(HCN)=c(Na+),可知混合后溶液中c(HCN)=0.5a mol/L﹣(0.5a﹣0.005)mol/L=0.005mol/L,电离平衡常数Ka(HCN)= ![]() =
= ![]() =(100a﹣1)×10﹣7 ,
=(100a﹣1)×10﹣7 ,
所以答案是:(100a﹣1)×10﹣7 .


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】下列基本实验操作中,不合理的是
A.分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁
B.可用湿润的pH试纸检验氨气
C.稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
D.试管可用酒精灯直接加热,也可用水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.合成纤维和人造纤维可统称为化学纤维
B.酚醛树脂和聚氯乙烯都是热固性塑料
C.锦纶丝接近火焰时先卷缩,灰烬为有光泽的硬块
D.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性能超过了单一材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断不正确的是( ) 
A.盐桥中的Cl﹣向甲池移动,滤纸上的SO42﹣向b移动
B.电子流动沿Zn→a,b→Cu的路径
C.Cu电极上的反应为:Cu2++2e﹣═Cu,滤纸a点发生还原反应
D.片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL的溶液中溶有0.1mol NaCl和0.1mol MgCl2 , 此溶液中Cl﹣的物质的量浓度为( )
A.3 mol/L
B.2 mol/L
C.0.3 mol/L
D.0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示: 
(1)反应①~⑤中,属于氧化还原反应的是(填编号).
(2)写出反应②的离子方程式 .
(3)X溶液中的主要阳离子是Na+和 .
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下: ①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③;④加适量盐酸;⑤ . (请补全缺少的实验步骤)
(5)检验纯碱样品中是否含NaCl应选用的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是 .
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 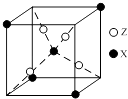
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( ) 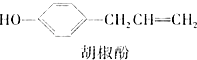
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2mol Br2发生反应.
A.①③
B.①②④
C.②③
D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com