
【题目】下列基本实验操作中,不合理的是
A.分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁
B.可用湿润的pH试纸检验氨气
C.稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
D.试管可用酒精灯直接加热,也可用水浴加热
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 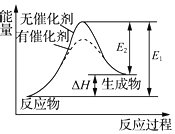
A.分子式为C2H4O的有机化合物性质相同
B.氯水和二氧化硫都具有漂白作用,两者漂白原理不相同
C.某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变
D.等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等
途径a:Cu ![]() CuO
CuO ![]() CuSO4;途径b:Cu
CuSO4;途径b:Cu ![]() CuSO4
CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下列有关我们常用的元素周期表的说法正确的是( )
A. 元素周期表有18个纵行,共有16个族
B. 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻
C. 短周期是指第一、二、三、四周期
D. IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验: 
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为 , . ②中离子方程式为 .
(2)①中长导管的作用是 .
(3)烧瓶中生成的红褐色油状液滴的成分是 , 要想得到纯净的产物,可用试剂洗涤.洗涤后分离粗产品应使用的仪器是 .
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是 . b中的试剂是 . 比较两套装置,装置Ⅱ的主要优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol H2O的摩尔质量和1mol H2O的摩尔质量
B.200 mL 1 molL﹣1氯化钙溶液中c(Cl﹣)和100 mL 2 molL﹣1氯化钾溶液中c(Cl﹣)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将190g MgCl2溶于水配制成1L溶液.
(1)该溶液中MgCl2的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的MgCl2溶液500mL,需该溶液的体积为 .
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等. 
(1)铜位于元素周期表区,基态铬原子的价电子排布式为 .
(2)碘酸及高碘酸的结构式如图1所示,酸性较强的是 , 理由是 .
(3)工业上制取单质可通过电解KHF2和HF混合溶液获得,HF2﹣中所包含的作用力有;与HF2﹣互为等电子体的分子为(任填一种).
(4)IO3﹣中碘原子的杂化轨道类型为 , IO3﹣的空间结构为 .
(5)用金属镁还原二氧化硅可得到一种硅镁化合物,其晶胞结构如图2所示.
已知Si4﹣位于晶胞的顶点和面心,Mg2+位于八个小立方体的中心,其晶体参数a=0.635nm.
①SiO2与SiF4相比,熔点更低的是(填化学式).
②硅镁化合物的化学式为;列式表示该硅镁化合物的密度:gcm﹣3(不必计算出结果,NA为阿伏伽德罗常数的数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中容易产生有害的含铬工业废水和含氰废水,严重威胁人类的健康和安全.图1是处理工业含铬废水和含氰废水的工艺流程. 
已知:含铬废水中铬的存在形式为Cr2O72﹣ , Cr元素常见的化合价+3、+6,含氰废水中有CN﹣存在.
请回答下列问题:
(1)含氰废水中有CN﹣存在,其中C元素的化合价为 .
的代数式表示)
(2)向含铬废水中加下列哪种物质将pH调整到2~3,(填字母).
a.稀盐酸 b.稀硫酸 c.稀硝酸
的代数式表示)
(3)pH>10时,图中反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,请写出反应的离子方程式 .
的代数式表示)
(4)经过图中反应Ⅰ和图中反应Ⅱ后,将两种废水混合的目的是
的代数式表示)
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72﹣的废水,原理示意图如图2: 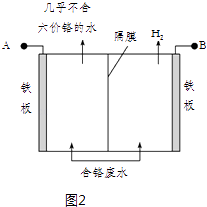
阳极区域溶液中发生反应的离子方程式为 . 若不考虑气体的溶解,当收集到H2 13.44L(标准状况)时,被还原的Cr2O72﹣物质的量为 . 为了使Cr3+和Fe3+转化为Fe (OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则溶液中c (Cr3+)=molL﹣1 . (已知:Ksp[Fe (OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
的代数式表示)
(6)在25℃下,将a molL﹣1 NaCN溶液与0.01molL﹣1盐酸等体积混合(忽略溶液体积变化),反应后测得溶液pH=7,HCN的电离常数Ka为 . (用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com