
【题目】将如图所示实验装置的K闭合,下列判断不正确的是( ) 
A.盐桥中的Cl﹣向甲池移动,滤纸上的SO42﹣向b移动
B.电子流动沿Zn→a,b→Cu的路径
C.Cu电极上的反应为:Cu2++2e﹣═Cu,滤纸a点发生还原反应
D.片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下列有关我们常用的元素周期表的说法正确的是( )
A. 元素周期表有18个纵行,共有16个族
B. 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻
C. 短周期是指第一、二、三、四周期
D. IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等. 
(1)铜位于元素周期表区,基态铬原子的价电子排布式为 .
(2)碘酸及高碘酸的结构式如图1所示,酸性较强的是 , 理由是 .
(3)工业上制取单质可通过电解KHF2和HF混合溶液获得,HF2﹣中所包含的作用力有;与HF2﹣互为等电子体的分子为(任填一种).
(4)IO3﹣中碘原子的杂化轨道类型为 , IO3﹣的空间结构为 .
(5)用金属镁还原二氧化硅可得到一种硅镁化合物,其晶胞结构如图2所示.
已知Si4﹣位于晶胞的顶点和面心,Mg2+位于八个小立方体的中心,其晶体参数a=0.635nm.
①SiO2与SiF4相比,熔点更低的是(填化学式).
②硅镁化合物的化学式为;列式表示该硅镁化合物的密度:gcm﹣3(不必计算出结果,NA为阿伏伽德罗常数的数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( ) 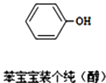
A.碳原子采用sp3杂化
B.氧原子采用sp2杂化
C.该有机物属于醇类
D.该分子中的13个原子有可能处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别碳酸钠和碳酸氢钠固体的方法中错误的是( )
A.分别取两种固体样品,加热产生气体的是碳酸氢钠
B.分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠
C.分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠
D.分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是NaOH、AlCl3、BaCl2、MgCl2四种物质中的一种,若将乙溶液滴入丁溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;乙溶液滴入丙溶液中,无明显现象发生。据此可推断甲物质是
A.BaCl2B.NaOHC.AlCl3D.MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中容易产生有害的含铬工业废水和含氰废水,严重威胁人类的健康和安全.图1是处理工业含铬废水和含氰废水的工艺流程. 
已知:含铬废水中铬的存在形式为Cr2O72﹣ , Cr元素常见的化合价+3、+6,含氰废水中有CN﹣存在.
请回答下列问题:
(1)含氰废水中有CN﹣存在,其中C元素的化合价为 .
的代数式表示)
(2)向含铬废水中加下列哪种物质将pH调整到2~3,(填字母).
a.稀盐酸 b.稀硫酸 c.稀硝酸
的代数式表示)
(3)pH>10时,图中反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,请写出反应的离子方程式 .
的代数式表示)
(4)经过图中反应Ⅰ和图中反应Ⅱ后,将两种废水混合的目的是
的代数式表示)
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72﹣的废水,原理示意图如图2: 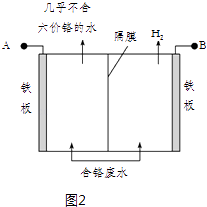
阳极区域溶液中发生反应的离子方程式为 . 若不考虑气体的溶解,当收集到H2 13.44L(标准状况)时,被还原的Cr2O72﹣物质的量为 . 为了使Cr3+和Fe3+转化为Fe (OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则溶液中c (Cr3+)=molL﹣1 . (已知:Ksp[Fe (OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
的代数式表示)
(6)在25℃下,将a molL﹣1 NaCN溶液与0.01molL﹣1盐酸等体积混合(忽略溶液体积变化),反应后测得溶液pH=7,HCN的电离常数Ka为 . (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义.
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 .
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响
①已知图甲中0~t1 min内,v(H2)=0.03molL﹣1min﹣1 , 则t1=;若从t2 min起仅改变一个反应条件,则所改变的条件可能是(填一种即可);图乙中,b点时n= .
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1molL﹣1 , c(N2)=0.5molL﹣1 , c(NH3)=0.1molL﹣1 , 则在平衡建立过程中NH3的浓度变化趋势是(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为、 .
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)
△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式: .
(4)以NO2为原料可以制得新型绿色硝化剂N2O5 , 原理是先将NO2转化为N2O4 , 然后采用电解法制备N2O5 , 其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:a.硝酸溶液;b.N2O4和无水硝酸,则左室加入的试剂应为(填代号),其电极反应式为 .
②若以甲醇燃料电池为电源进行上述电解,已知:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com