
【题目】研究氮及其化合物对化工生产有重要意义.
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 .
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响
①已知图甲中0~t1 min内,v(H2)=0.03molL﹣1min﹣1 , 则t1=;若从t2 min起仅改变一个反应条件,则所改变的条件可能是(填一种即可);图乙中,b点时n= .
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1molL﹣1 , c(N2)=0.5molL﹣1 , c(NH3)=0.1molL﹣1 , 则在平衡建立过程中NH3的浓度变化趋势是(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为、 .
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)
△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式: .
(4)以NO2为原料可以制得新型绿色硝化剂N2O5 , 原理是先将NO2转化为N2O4 , 然后采用电解法制备N2O5 , 其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:a.硝酸溶液;b.N2O4和无水硝酸,则左室加入的试剂应为(填代号),其电极反应式为 .
②若以甲醇燃料电池为电源进行上述电解,已知:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
【答案】
(1)30 min;降低温度或增大H2浓度;3;逐渐减小
(2)N2H4+H2O?N2H5++OH﹣;N2H5++H2O?N2H62++OH﹣
(3)2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4 kJ?mol﹣1
(4)b;N2O4+2HNO3﹣2e﹣=2N2O5+2H+;95%
【解析】解:(1)①0~t1 min内,v(H2)=0.03molL﹣1min﹣1 , 则v(N2)=0.01molL﹣1min﹣1 , 则v= ![]() =
= ![]() =0.01molL﹣1min﹣1 , 解得t1=30 min;从t2min起N2的浓度逐渐减小,可能是降低温度或增大H2浓度使平衡正向移动引起的;
=0.01molL﹣1min﹣1 , 解得t1=30 min;从t2min起N2的浓度逐渐减小,可能是降低温度或增大H2浓度使平衡正向移动引起的;
当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大,即图乙中,b点时n=3;
所以答案是:30 min;降低温度或增大H2浓度;3;②c(H2)=0.1molL﹣1 , c(N2)=0.5molL﹣1 , c(NH3)=0.1molL﹣1 , 则Qc= ![]() =
= ![]() =20>10,所以反应逆向进行,NH3的浓度逐渐减小;
=20>10,所以反应逆向进行,NH3的浓度逐渐减小;
所以答案是:逐渐减小;(2)N2H4是二元弱碱,其电离分步进行,第一步N2H4部分电离出OH﹣、N2H5+ , 电离方程式为:N2H4+H2ON2H5++OH﹣ , 则第二步中N2H5+在溶液中部分电离出出OH﹣、N2H62+ , 电离方程式为:N2H5++H2ON2H62++OH﹣;
所以答案是:N2H4+H2ON2H5++OH﹣;N2H5++H2ON2H62++OH﹣;(3)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
根据盖斯定律可知反应②×2﹣反应①即得到反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4 kJmol﹣1;
所以答案是:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4 kJmol﹣1;(4)①装置图中与电源正极相连的电极为阳极,与电源负极相连的电极为阴极,从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故生成N2O5的左室为阳极,右室为阴极,生成N2O5的反应式为N2O4+2HNO3﹣2e﹣=2N2O5+2H+;
所以答案是:b;N2O4+2HNO3﹣2e﹣=2N2O5+2H+;
②1mol液态CH3OH变成气态CH3OH需吸热11KJ,CH3OH(g)=CH3OH(l)△H=﹣11KJ/mol①,1mol液态水变成气态水需吸热44KJ,H2O(g)=H2O(l)△H=﹣44KJ/mol②,CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1③,则③﹣①+②×2得:CH3OH(l)+
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1③,则③﹣①+②×2得:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=(﹣651KJ/mol+11KJ/mol﹣88KJ/mol)=﹣728KJ/mol,理想状态下,该燃料电池消耗0.5molCH3OH(1)产生的热量为
O2(g)═CO2(g)+2H2O(l)△H=(﹣651KJ/mol+11KJ/mol﹣88KJ/mol)=﹣728KJ/mol,理想状态下,该燃料电池消耗0.5molCH3OH(1)产生的热量为 ![]() =364KJ,所以该燃料电池的理论效率为
=364KJ,所以该燃料电池的理论效率为 ![]() ×100%=95%;
×100%=95%;
所以答案是:95%;
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%,以及对弱电解质在水溶液中的电离平衡的理解,了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断不正确的是( ) 
A.盐桥中的Cl﹣向甲池移动,滤纸上的SO42﹣向b移动
B.电子流动沿Zn→a,b→Cu的路径
C.Cu电极上的反应为:Cu2++2e﹣═Cu,滤纸a点发生还原反应
D.片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)分子中有18个氢原子的链烷烃的分子式:
(2)2,3﹣二甲基﹣1﹣丁烯的结构简式:
(3)用系统法命名: 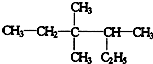
(4)CH2=CH﹣C≡CH结构中碳原子轨道的杂化方式是
(5)有机物的结构可用“键线式”简化表示.如CH3﹣CH=CH﹣CH3可简写为 ![]() ,
,  的分子式为 , 1mol该烃完全燃烧,需要标准状况下氧气升;该烃的一溴取代物有种.
的分子式为 , 1mol该烃完全燃烧,需要标准状况下氧气升;该烃的一溴取代物有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁、铝的混合物共0.1mol,溶于200mL 2.5molL﹣1的盐酸溶液中,然后再滴加2molL﹣1的NaOH溶液.请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示.当V1=120mL时,则金属粉末中n(Al)=mol. 
(2)V2~V3段发生反应的离子方程式为 .
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面合成路线完成有关问题: 
(1)写出A、B、C结构简式:A: , B: , C: .
(2)各步反应类型:① , ② , ③ , ④ , ⑤ . ②的反应条件
(3)写出反应④的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( ) 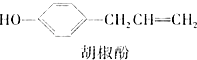
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2mol Br2发生反应.
A.①③
B.①②④
C.②③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种航天器能量储存系统原理示意图.下列说法正确的是( ) 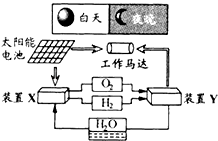
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO47H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2 CH2COO)2 Fe〕.有关物质性质:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1molL﹣1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
回答下列问题:
(1)实验I中:铁粉的作用是;生成沉淀的离子方程式为 .
(2)实验II中:
①装置B中试剂为 .
②当C中空气排净后,应停止滴加盐酸,打开止水夹 , 关闭止水夹
③装置D中Ca(OH)2的作用是 .
④柠檬酸可调节pH,体系pH与产率的关系如表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
pH过低使产率下降的原因是;柠檬酸的作用还有(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是 .
⑥若产品的质量为m g,则产率为
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节): .
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com