
����Ŀ��ʵ�������̷���FeSO47H2O��Ϊ��Դ�Ʊ��������ʰ�������[��NH2 CH2COO��2 Fe�����й��������ʣ�
�ʰ��ᣨNH2CH2COOH�� | ������ | �ʰ������� |
������ˮ�������Ҵ������Ի����� | ������ˮ���Ҵ�����ǿ���Ժͻ�ԭ�� | ������ˮ���������Ҵ� |
ʵ����̣�
I���Ʊ�FeCO3����0.10mol�̷�����ˮ�У������������ۣ��߽����������1.1molL��1NH4HCO3��Һ200mL����Ӧ��������˲�ϴ�ӳ�����
II���Ʊ���NH2 CH2 COO�� 2Fe��ʵ��װ����ͼ���гֺͼ���������ʡ�ԣ�������A�з�Ӧ��C�п����ž����ٽ����������ͺ�0.20mol�ʰ����ˮ��Һ��Ϻ����C�У����������Ტ���ȣ���Ӧ��������ˣ���Һ����Ũ���������Ҵ������ˡ�����õ���Ʒ��
�ش��������⣺
��1��ʵ��I�У����۵������������ɳ��������ӷ���ʽΪ ��
��2��ʵ��II�У�
��װ��B���Լ�Ϊ ��
�ڵ�C�п����ž���Ӧֹͣ�μ����ᣬ��ֹˮ�� �� �ر�ֹˮ��
��װ��D��Ca��OH��2�������� ��
��������ɵ���pH����ϵpH����ʵĹ�ϵ�����
ʵ�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
��ϵpH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
����/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686�� |
pH����ʹ�����½���ԭ����������������û���������ţ���
a������Ӧ�յ�ָʾ�� b����ֹ������������ c���ٽ�FeCO3�ܽ� d��������
���Ҵ��������� ��
������Ʒ������Ϊm g�������Ϊ
��3�����ʵ�鷽���ⶨ��Ʒ�ж��������������������������̵�ϸ�ڣ��� ��
����֪��Ʒ�д����������������ҽ����������������������±�KMnO4��NaC1O��H2 O2����������������
���𰸡�
��1����ֹ��������������Fe2++2HCO3��=FeCO3��+CO2��+H2O
��2������NaHCO3��Һ��b��a���ж�װ���п����Ƿ��ž���H+����NH2CH2COOH��Ӧ��bc�����ʰ���������ˮ�е��ܽ�ȣ���߲��ʺʹ��ȣ�![]() ��100%
��100%
��3����ȡһ�������IJ�Ʒ����ˮ�У���������H2SO4�ữ����KMnO4����Һ�ζ�����¼���ĵ�������ظ�ʵ��2��3��
���������⣺��1�����������н�ǿ�Ļ�ԭ�ԣ����Ʊ�̼�������Ĺ����У�Ϊ�˷�ֹ��������������������������ۣ��̷���ˮ��Һ��NH4HCO3��Һ��Ӧ�ķ���ʽΪ Fe2++2HCO3��=FeCO3��+CO2��+H2O�����Դ��ǣ���ֹ��������������Fe2++2HCO3��=FeCO3��+CO2��+H2O����2��������ϡ������ʯ�����Ʊ�������̼�Ĺ����У�HCl�лӷ��ԣ�Ϊ�˱���ӷ�����HCl���ź������飬�����ȥ����ѡ�ñ���NaHCO3��Һ�����Դ��ǣ�����NaHCO3��Һ���ڵ�C�п����ž���Ӧֹͣ�μ����ᣬ�Ʊ�����˹��̲���Ҫ������̼����Ҫ�����������ʲ��ܽ����Ҳ�ķ�Ӧװ�ã���Ӳ�ر�ֹˮ��b����ֹˮ��a�����Դ��ǣ�b��a����װ��D��Ca��OH��2���������ж�װ���п����Ƿ��ž�����������������Ҫ�����������������ʵ����ɸ��ţ����Դ��ǣ��ж�װ���п����Ƿ��ž��� ��pH����ʹ�����½���ԭ����H+����NH2CH2COOH�еİ�����Ӧ����������ǿ���Ժͻ�ԭ�ԣ����û��дٽ�FeCO3�ܽ⣬��ֹ�����������������Դ��ǣ�H+����NH2CH2COOH��Ӧ��bc�������ڸʰ�������������ˮ���������Ҵ������Ҵ��������ǽ��ʰ���������ˮ�е��ܽ�ȣ���߲��ʺʹ��ȣ����Դ��ǣ����ʰ���������ˮ�е��ܽ�ȣ���߲��ʺʹ��ȣ� ����ԭ���غ㣬�̷��е���Ԫ��Ϊ0.10mol��������NH4HCO3��Һ�������ʸ�����ԭ���غ�֪�����ϲ���[��NH2 CH2COO��2 Fe0.10mol��������Ϊ20.4g���ʲ���= ![]() =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����3���ⶨ��Ʒ�ж�������������ȡһ�������IJ�Ʒ����ˮ�У���������H2SO4�ữ����KMnO4����Һ�ζ�����¼���ĵ�������ظ�ʵ��2��3�Σ��ɸ������ĵĸ�����ص���������������������Դ��ǣ���ȡһ�������IJ�Ʒ����ˮ�У���������H2SO4�ữ����KMnO4����Һ�ζ�����¼���ĵ�������ظ�ʵ��2��3�Σ�
����3���ⶨ��Ʒ�ж�������������ȡһ�������IJ�Ʒ����ˮ�У���������H2SO4�ữ����KMnO4����Һ�ζ�����¼���ĵ�������ظ�ʵ��2��3�Σ��ɸ������ĵĸ�����ص���������������������Դ��ǣ���ȡһ�������IJ�Ʒ����ˮ�У���������H2SO4�ữ����KMnO4����Һ�ζ�����¼���ĵ�������ظ�ʵ��2��3�Σ�


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯����Ի�����������Ҫ���壮
��1����ҵ�ϳɰ���ԭ��ΪN2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1 ��
��ͼ�ױ�ʾ��һ��������ܱ������з�ӦʱN2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£��ı���ʼͶ����H2��N2�����ʵ���֮�ȣ���Ϊn���Ը�ƽ���Ӱ��
����֪ͼ����0��t1 min�ڣ�v��H2��=0.03molL��1min��1 �� ��t1=������t2 min����ı�һ����Ӧ�����������ı����������������һ�ּ��ɣ���ͼ���У�b��ʱn= ��
����֪ij�¶��¸÷�Ӧ��K=10�����¶�����������ͬʱ��������Ũ�ȵĻ�����壺c��H2��=0.1molL��1 �� c��N2��=0.5molL��1 �� c��NH3��=0.1molL��1 �� ����ƽ�⽨��������NH3��Ũ�ȱ仯�����������������С���㶨���䡱����
��2����֪�£�N2H4���Ƕ�Ԫ���������Ƿֲ��ģ����뷽��ʽΪ�� ��
��3���й�����Ƽ����Ź�˾�ƻ���2015�����20������������£�N2H4������Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2��g��+2O2��g���TN2O4��l��
��H1=��195kJmol��1
��N2H4��l��+O2��g���TN2��g��+2H2O��g��
��H2=��534.2kJmol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�� ��
��4����NO2Ϊԭ�Ͽ����Ƶ�������ɫ������N2O5 �� ԭ�����Ƚ�NO2ת��ΪN2O4 �� Ȼ����õ�ⷨ�Ʊ�N2O5 �� ��װ����ͼ����ʾ��������ʯī�缫���м����ֻ��������ͨ����������ˮ����ͨ����
����֪���Ҽ�����Լ��ֱ��ǣ�a��������Һ��b��N2O4����ˮ���ᣬ�����Ҽ�����Լ�ӦΪ������ţ�����缫��ӦʽΪ ��
�����Լ״�ȼ�ϵ��Ϊ��Դ����������⣬��֪��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2O��g����H=��651kJmol��1 �� ��֪�״���ˮ�������ȷֱ�Ϊ11kJmol��1��44kJmol��1 �� ��״���£���ȼ�ϵ������0.5mol CH3OH������������Ϊ345.8kJ����õ�ص�����Ч��Ϊ����ص�����Ч��=������������������������ͷŵ�ȫ������֮�ȣ���
O2��g���TCO2��g��+2H2O��g����H=��651kJmol��1 �� ��֪�״���ˮ�������ȷֱ�Ϊ11kJmol��1��44kJmol��1 �� ��״���£���ȼ�ϵ������0.5mol CH3OH������������Ϊ345.8kJ����õ�ص�����Ч��Ϊ����ص�����Ч��=������������������������ͷŵ�ȫ������֮�ȣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��Q��T��ԭ���������䳣�����ϼ۹�ϵ��ͼ������˵����ȷ���ǣ� �� 
A.1 mol TX2������X2��Ӧ����TX3�ķ�����ĿΪNA
B.ZԪ���γɵĿ���������Һ�����Լ���
C.1 mol Y2X2������H2O��Ӧת�Ƶĵ�����ĿΪ2NA
D.0.1 molQԪ�صĺ�������ˮ�е������Hʮ��ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʷ�����Ӧ�����ɲ���������ǣ�������
A.Na2S2O3��Һ��HCl��ҺB.H2S������������O2��ȼ��
C.̼��Ũ���ᷴӦD.ͭ��Ũ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������In������Ϊ��Ϣ��ҵ�е�������Ԫ������������49In-114.8��������֪�����ǣ�������
A.��Ԫ�ص����ԭ������B.��Ԫ�ص�ԭ������
C.��ԭ�ӵ����ԭ������D.��ԭ�ӵĺ˵����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2���ȱ�����ȡ������1��2�������� ![]() ʱ����Ҫ���������ļ�����Ӧ�� ��
ʱ����Ҫ���������ļ�����Ӧ�� ��
A.��ȥ���ӳɡ�ȡ��
B.�ӳɡ���ȥ��ȡ��
C.ȡ������ȥ���ӳ�
D.��ȥ���ӳɡ���ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧ��ʵ�飬�ܹ��ﵽʵ��Ŀ���ǣ� ��
A.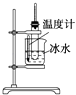 ʵ������ȡ������������
ʵ������ȡ������������
B.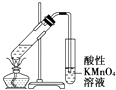 ֤�������顢NaOH���Ҵ���Һ����������ϩ
֤�������顢NaOH���Ҵ���Һ����������ϩ
C.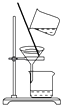 ��������������̼���ƺ�ˮ�Ļ����
��������������̼���ƺ�ˮ�Ļ����
D.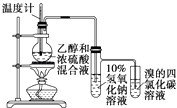 ֤���Ҵ���Ũ���Ṳ��������ϩ
֤���Ҵ���Ũ���Ṳ��������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾþ���ʯ(Mg2SiO4)��ɵ���������ʽ��(����)
A.MgO��SiO2
B.2MgO��SiO2
C.MgO��2SiO2
D.2MgO��2SiO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com