
【题目】根据下面合成路线完成有关问题: 
(1)写出A、B、C结构简式:A: , B: , C: .
(2)各步反应类型:① , ② , ③ , ④ , ⑤ . ②的反应条件
(3)写出反应④的化学方程式: .
【答案】
(1)![]() ;
;![]() ;
;![]()
(2)加成反应;消去反应;加成反应;消去反应;加成反应;氢氧化钠醇溶液、加热
(3)![]() +2NaOH
+2NaOH ![]()
![]() +2NaCl+2H2O
+2NaCl+2H2O
【解析】解:对比氯苯与1,2﹣二氯环己烷的结构,可知氯苯与氢气发生加成反应生成A为 ![]() ,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为
,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为 ![]() ,B与氯气发生加成反应生成1,2﹣二氯环己烷,对比1,2﹣二氯环己烷与1,2,3,4﹣四氯环己烷的结构可知,1,2﹣二氯环己烷发生消去反应生成C为
,B与氯气发生加成反应生成1,2﹣二氯环己烷,对比1,2﹣二氯环己烷与1,2,3,4﹣四氯环己烷的结构可知,1,2﹣二氯环己烷发生消去反应生成C为 ![]() ,C与氯气在发生加成反应生成1,2,3,4﹣四氯环己烷.(1)由上述分析可知,A为
,C与氯气在发生加成反应生成1,2,3,4﹣四氯环己烷.(1)由上述分析可知,A为 ![]() ,B为
,B为 ![]() ,C为
,C为 ![]() ,所以答案是:
,所以答案是: ![]() ;
; ![]() ;
; ![]() ;(2)由上述分析可知,反应①为加成反应,反应②为消去反应,反应③为加成反应,反应④为消去反应,反应⑤为加成反应,②的反应条件为:氢氧化钠醇溶液、加热,所以答案是:加成反应;消去反应;加成反应;消去反应;加成反应;氢氧化钠醇溶液、加热;(3)A→B发生卤代烃的消去反应,反应试剂及条件:氢氧化钠醇溶液、加热,所以答案是:氢氧化钠醇溶液、加热;(4)反应④的化学方程式为
;(2)由上述分析可知,反应①为加成反应,反应②为消去反应,反应③为加成反应,反应④为消去反应,反应⑤为加成反应,②的反应条件为:氢氧化钠醇溶液、加热,所以答案是:加成反应;消去反应;加成反应;消去反应;加成反应;氢氧化钠醇溶液、加热;(3)A→B发生卤代烃的消去反应,反应试剂及条件:氢氧化钠醇溶液、加热,所以答案是:氢氧化钠醇溶液、加热;(4)反应④的化学方程式为 ![]() +2NaOH
+2NaOH ![]()
![]() +2NaCl+2H2O,所以答案是:
+2NaCl+2H2O,所以答案是: ![]() +2NaOH
+2NaOH ![]()
![]() +2NaCl+2H2O.
+2NaCl+2H2O.


科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是NaOH、AlCl3、BaCl2、MgCl2四种物质中的一种,若将乙溶液滴入丁溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;乙溶液滴入丙溶液中,无明显现象发生。据此可推断甲物质是
A.BaCl2B.NaOHC.AlCl3D.MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构和元素周期律的表述正确的是 ( )
A. 第二周期元素的最高正价和负价的绝对值之和等于8
B. ⅦA族元素一定是同周期中非金属性最强的元素
C. 氮的非金属性比磷强,所以氮气的性质比白磷活泼
D. Na+半径大于Cl-半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义.
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 .
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响
①已知图甲中0~t1 min内,v(H2)=0.03molL﹣1min﹣1 , 则t1=;若从t2 min起仅改变一个反应条件,则所改变的条件可能是(填一种即可);图乙中,b点时n= .
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1molL﹣1 , c(N2)=0.5molL﹣1 , c(NH3)=0.1molL﹣1 , 则在平衡建立过程中NH3的浓度变化趋势是(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为、 .
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)
△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式: .
(4)以NO2为原料可以制得新型绿色硝化剂N2O5 , 原理是先将NO2转化为N2O4 , 然后采用电解法制备N2O5 , 其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:a.硝酸溶液;b.N2O4和无水硝酸,则左室加入的试剂应为(填代号),其电极反应式为 .
②若以甲醇燃料电池为电源进行上述电解,已知:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸在空气中有如此反应:2H2S+O2=2S↓+2 H2O,下列不正确的是( )
A. 还原性:H2O> H2S B. 属于置换反应
C. 氧化性:O2> S D. 酸性:H2S> H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( ) 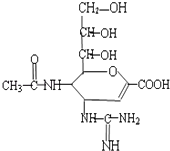
A.该物质的分子式为C12H20N4O7
B.1mol该物质与NaOH溶液反应,可以消耗4molNaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:
(2)气流从左至右,装置接口连接顺序是a
(3)装置C中干燥管中所盛试剂的名称是: , 作用是:
(4)装置C中酒精灯的作用是:
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00molL﹣1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl﹣)滴定结果如表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 1.04 | 25.03 |
2 | 1.98 | 25.99 |
3 | 3.20 | 25.24 |
①写出滴定过程中所发生的2个离子方程式:
②样品中氯化亚铁的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(In)被称为信息产业中的“朝阳元素”。由“铟49In-114.8”不可能知道的是( )
A.铟元素的相对原子质量B.铟元素的原子序数
C.铟原子的相对原子质量D.铟原子的核电荷数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com