
某同学在学习核外电子排布的知识时,把15P原子的电子排布式写成了1s22s22P63s23Px23Py1,他违背了
| A.能量守恒原理 | B.泡利不相容原理 | C.能量最低原则 | D.洪特规则 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:单选题
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素, 它们的最高价氧化物的水化物之间相互反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,其低价氧化物具有漂白作用;W与Y可形成化合物W2Y。下列说法正确的是
| A.Y的低价氧化物与O3漂白的原理相同 |
| B.Y的氢化物和W2Y所含化学键的类型相同 |
| C.上述三种元素形成的简单离子,X离子半径最小 |
| D.工业上常用电解相应的盐溶液制备W、X的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是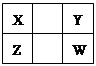
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z的原子序数不可能是X的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有四种元素的基态原子的电子排布式如下 ①1s22s22p63s23p4 ②1s22s22p63s23p3; ③1s22s22p5下列正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.不成对电子数:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型
③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型
| A.①④②③ | B.①②④③ | C.②①④③ | D.①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素A、B、C、D、E的原子序数依次增大,相互间满足如下关系:A的气态氢化物极易溶于B的液态氢化物中;常温下,C的单质能溶于D的最高价氧化物的水化物的稀溶液,但被其浓溶液钝化,下列说法错误的是
A.AB2溶于水可促进水的电离
B.原子半径的大小顺序:C>D>B
C.B与C形成的常见化合物属于离子化合物
D.E的气态单质能将D的单质从其气态氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1 H原子核和2个电子构成。下列关于这种粒子的说法中,正确的是( )
| A.它是氢的一种新同位素 | B.这种新元素的核电荷数是3 |
| C.它是H2的一种新同素异形体 | D.它比一个普通氢分子多—个氢核 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com