
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
(查阅资料)
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(实验探究)
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:
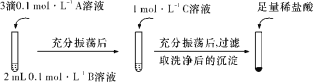
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | ||||
实验Ⅱ | BaCl2 | |||
Na2CO3 | Na2SO4 | …… | ||
Na2SO4 | 有少量气泡产生,沉淀部分溶解 |
(1)实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入稀盐酸后,__________。
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_________。
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:___________。
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。
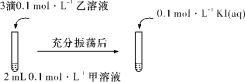
甲溶液可以是______(填字母代号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 |
| ||
ⅰ.按图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
ⅲ.再向B中投入一定量NaCl(s) | c | |
ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率__________(填“大于”或“小于”)沉淀反应速率。设计(-)石墨(s)[I-(aq)//Ag+(aq)]石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)如上图所示,则该原电池总反应的离子方程式为________。
②结合信息,解释实验Ⅳ中b<a的原因:__________。
③实验Ⅳ的现象能说明AgI转化为
(实验结论)溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
【答案】沉淀不溶解,无气泡产生或无明显现象 BaCO3+2H+=Ba2++CO2↑+H2O BaSO4在溶液中存在沉淀溶解平衡BaSO4(s) ![]() Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动 b 小于 2Ag++2I-=I2+2Ag 生成AgI沉淀使B中的溶液中的c(I-)减小,I-还原性减弱,原电池的电压减小 实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)
Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动 b 小于 2Ag++2I-=I2+2Ag 生成AgI沉淀使B中的溶液中的c(I-)减小,I-还原性减弱,原电池的电压减小 实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)![]() AgCl(s)+I-(aq)
AgCl(s)+I-(aq)
【解析】
⑴因为BaCO3能溶于盐酸,放出CO2气体,BaSO4不溶于盐酸。
⑵实验Ⅱ是将少量BaCl2中加入Na2SO4溶液中,再加入Na2CO3溶液使部分BaSO4转化为BaCO3,则加入盐酸后有少量气泡产生,沉淀部分溶解。
⑶BaSO4在溶液中存在沉淀溶解平衡BaSO4(s) ![]() Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀。
Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀。
⑷向AgCl的悬浊液中加入KI溶液,获得AgCl悬浊液时NaCl相对于AgNO3过量,因此说明有AgCl转化为AgI。
⑸①AgNO3溶液与KI溶液混合总是先得到AgI沉淀说明氧化还原反应远远小于沉淀反应速率;原电池总反应的离子方程式为2I-+2Ag+ = 2Ag+I2;②由于AgI的溶解度小于AgCl,B中加入AgNO3溶液后,产生了AgI沉淀,使B中的溶液中的c(I-)减小,I-还原性减弱,根据已知信息“其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关”可的结论;③实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)![]() AgCl(s)+I-(aq)。
AgCl(s)+I-(aq)。
⑴因为BaCO3能溶于盐酸,放出CO2气体,BaSO4不溶于盐酸,所以实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,沉淀不溶解,无气泡产生(或无明显现象);故答案为:沉淀不溶解,无气泡产生或无明显现象。
⑵实验Ⅱ是将少量BaCl2中加入Na2SO4溶液中,再加入Na2CO3溶液使部分BaSO4转化为BaCO3,则加入盐酸后有少量气泡产生,沉淀部分溶解,发生反应的离子方程式为BaCO3+2H+ = Ba2++CO2↑+H2O;故答案为:BaCO3+2H+ = Ba2++CO2↑+H2O。
⑶BaSO4在溶液中存在沉淀溶解平衡BaSO4(s) ![]() Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动,BaSO4沉淀部分转化为BaCO3沉淀;故答案为:BaSO4在溶液中存在沉淀溶解平衡BaSO4(s)
Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动,BaSO4沉淀部分转化为BaCO3沉淀;故答案为:BaSO4在溶液中存在沉淀溶解平衡BaSO4(s) ![]() Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
Ba2+(aq)+SO42(aq),当加入浓度较高的Na2CO3溶液,CO32与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
⑷为观察到AgCl转化为AgI,需向AgCl的悬浊液中加入KI溶液,获得AgCl悬浊液时NaCl相对于AgNO3过量,因此说明有AgCl转化为AgI;故答案为:b。
⑸①AgNO3溶液与KI溶液混合总是先得到AgI沉淀说明氧化还原反应远远小于沉淀反应速率;原电池总反应的离子方程式为2I-+2Ag+ = 2Ag+I2;故答案为:小于;2I-+2Ag+= 2Ag+I2。
②由于AgI的溶解度小于AgCl,B中加入AgNO3溶液后,产生了AgI沉淀,使B中的溶液中的c(I-)减小,I-还原性减弱,根据已知信息“其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关”可知,实验Ⅳ中b<a;故答案为:生成AgI沉淀使B中的溶液中的c(I-)减小,I-还原性减弱,原电池的电压减小。
③实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)![]() AgCl(s)+I-(aq);故答案为:实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)
AgCl(s)+I-(aq);故答案为:实验步骤ⅳ表明Cl-本身对该原电池电压无影响,实验步骤ⅲ中c>b说明加入Cl-使c(I-)增大,证明发生了AgI(s)+Cl-(aq)![]() AgCl(s)+I-(aq)。
AgCl(s)+I-(aq)。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4g H2O和26.4g CO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式_______________________。(写出计算过程)
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为____________(可以不化简,写出计算过程)。

(3)已知该有机物能够与金属钠或钾发生反应,并对有机物进行核磁共振操作,发现核磁共振氢谱图上有三组吸收峰,且峰面积之比为6:1:1,请写出该物质的结构简式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应 ①自发进行的条件是________________,ΔH3 =_____________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
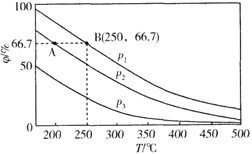
①其中,p1、p2和p3由大到小的顺序是________,其原因是_________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
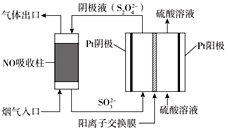
①阴极区的电极反应式为_____________________________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银由于其优良的性能和特性被广泛应用于照相、电子、电气等工业。废定影液中银主要以Na3Ag(S2O3)2形式存在,实验室用废定影液制备Ag的具体流程如图所示:
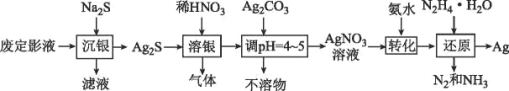
注:“还原”时由于Ag+直接与N2H4H2O反应过于激烈,所以采用加入氨水,使Ag+与氨形成[Ag(NH3)2]+,降低Ag+的浓度,从而相应降低Ag+的氧化能力,使反应能够平稳进行。
回答下列问题:
(1)“溶银”时产生的气体是___(填化学式)。
(2)N2H4H2O(水合肼)为无色透明的油状发烟液体,具有强还原性,实验室制备原理为NaClO+2NH3=N2H4H2O+NaCl,可能用到的实验装置如图所示:
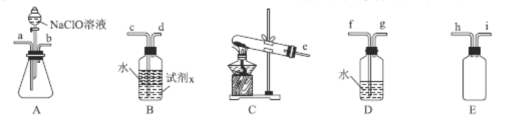
①本实验中用不到的装置是___。(填字母),试剂x是___(填化学式,任写一种)。
②加入NaClO溶液时要慢慢滴加,目的是___。
③按气流从左到右的方向,整套装置的连接顺序为___(填仪器接口小写字母)。
(3)AgNO3见光或受热易分解。将上述流程中AgNO3溶液蒸发浓缩可获得AgNO3固体,实验装置如图所示:
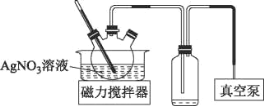
①使用真空泵的目的是___。
②测定AgNO3固体的纯度(杂质不参与反应)称取2.00g制备的AgNO3固体,加水溶解,定容到100mL;准确量取25.00mL溶液,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000molL-1NH4SCN标准溶液滴定,消耗NH4SCN标准溶液的平均体积为29.00mL,则固体中AgNO3的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应N2(g)+3H2(g)![]() 2NH3(g)达平衡的标志是( )
2NH3(g)达平衡的标志是( )
A.v正(N2)=v逆(N2)B.v正(N2)=3v正(H2)
C.v正(H2)=3v逆(NH3)D.N2、H2、NH3的体积比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成NH3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型塑料膜材料ETFE[名称为聚氟乙烯,化学式(C2H2F2)n],美观、耐用,可以使用15至20年,以下关于聚氟乙烯的说法不正确的是( )
A.聚氟乙烯属于有机物B.聚氟乙烯是加聚反应的产物
C.聚氟乙烯溶于水,易与空气中的氧气反应D.聚氟乙烯中碳元素的质量分数为37.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com