
【题目】如图是常见四种有机物的比例模型示意图。下列说法正确的是
A. 能使酸性高锰酸钾溶液褪色
能使酸性高锰酸钾溶液褪色
B. 可与溴水发生取代反应使溴水褪色
可与溴水发生取代反应使溴水褪色
C. 中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
D. 在稀硫酸作用下可与乙酸发生酯化反应
在稀硫酸作用下可与乙酸发生酯化反应
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某小组为探究K2Cr2O7中Cr在不同条件下存在的主要形式及性质特点。室温下(除系列实验I中ii外)进行了如下系列实验:
系列实验I | 装置 | 滴管中的试剂 | 试管中的试剂 | 操作 | 现象 |
i |
| 1 mL水 | 4mL 0.1 mol·L-1 K 2Cr2O7 橙色溶液 | 振荡 | 溶液颜色略微变浅 |
ii | 1 mL水 | 振荡 60℃水浴 | 溶液颜色较i明显变浅 | ||
iii | 1 mL 18.4 mol·L-1 浓硫酸 | 振荡 | 溶液颜色较i明显变深 | ||
iv | 1 mL 6 mol·L-1 NaOH 溶液 | 振荡 | _____________________ | ||
v | 3滴浓KI溶液 | iv中溶液 | 振荡 | 无明显现象 | |
vi | 过量稀硫酸 | v中溶液 | 边滴边振荡 | 溶液颜色由黄色逐渐变橙色,最后呈墨绿色 |
已知:K2CrO4溶液为黄色;Cr3+在水溶液中为绿色。
请按要求回答下列问题:
(1)写出K2C2O7在酸性条件下平衡转化的离子方程式:________________________。对比实验i与ii,可得结论是该转化反应的△H______0(填>”或“<”)。
(2)结合实验i、ii,分析导致ii中现象出现的主要因素是__________________。
(3)推测实验iv中实验现象为________________________。对比实验i、ii、iv中实验现象,可知,常温下K2Cr2O7中Cr在碱性条件下主要以______离子形式存在。
(4)对比实验v与vi,可知:在______条件下,+6价Cr被还原为______。
(5)应用上述实验结论,进一步探究含Cr2O72-废水样品用电解法处理效果的影响因素,实验结果如下表所示(Cr2O72-的起始浓度、体积,电压、电解时间等均相同)。
系列实验Ⅱ | i | ii | iii | iv |
样品中是否加Fe2(SO4)3 | 否 | 否 | 加入5 g | 否 |
样品中是否加入稀硫酸 | 否 | 加入1 mL | 加入1 mL | 加入1 mL |
电极材料 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 | ||
Cr2O72- | 0.922 | 12.7 | 20.8 | 57.3 |
①实验中Cr2O72-在阴极的反应式:_________________________________________________。

②实验i中Fe3+去除Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后没有未配对电子;C原子的2p轨道上没有空轨道上且电子的自旋方向相同;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)下列元素的名称是:B:________;E:________;
(2)D原子在元素周期表的___________区。
(3)C原子的电子排布图____________________。
(4)B原子的核外价电子排布式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.0.1 molN5+离子中所含的电子数为3.4NA
C.1 mol甲烷和NA个甲烷分子的质量相等
D.16 g氧气和16 g臭氧所含的原子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
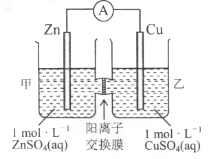
A. 锌电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 平衡时的压强是起始压强的1.2倍
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+ Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体。以A和B为原料合成扁桃酸衍生物F的路线如下:
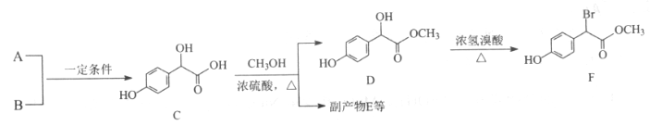
(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为______。写出A+B→C的化学反应方程式:__________________。
(2)C( )中①、②、③3个一OH的酸性由弱到强的顺序是_____。
)中①、②、③3个一OH的酸性由弱到强的顺序是_____。
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有______种。
(4)D→F的反应类型是_____,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为______mol。写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:__________。
①属于一元酸类化合物:②苯环上只有2个取代基且处于对位,其中一个是羟基。
(5)已知:R一CH2COOH![]() R一
R一![]() 一COOH A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:______________________
一COOH A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:______________________
CH2=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是

A. 三种酸对应电离常数Ka的大小关系为:HD<HB<HA
B. 滴定至P点时,溶液中:c(Na+)+ c(H+) = c(OH-)+ c(HB)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,三种溶液中:c(A-)<c(B-)<c(D-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )。
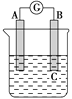
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com