
【题目】氢气是热量高、无污染的燃料,天然气储量丰富是理想的制氢原料,研究甲烷制氢具有重要的理论和现实意义。
(1)甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
(2)①将甲烷水蒸气重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸气约15:7:1体积比进料(空气中氧气体积分数约为0.2),可以实现反应器中能量自给(不需要补充热量)。
甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=____kJmol-1
②实际生产中,空气、甲烷、水蒸气按照约1:1:2体积比进料,增加水蒸气的作用是____,还能发生____(用化学方程式表示)反应,从而获得更多的氢气。
(3)甲烷水蒸气重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,2-5s甲烷质量分数由7.32%变为5.32%,用甲烷表示2-5s的反应速率为____molmin-1 ,随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定,造成____。有人提出将甲烷水蒸气重整和甲烷氧化重整两种方法结合则能解决这个问题,原因是____。
【答案】50% 2.16×10-3 1:1 -72 促进反应正向移动,提高甲烷的转化率 CO+H2O![]() CO2+H2 1.2 催化剂积碳 氧气会与积碳反应,从而消碳
CO2+H2 1.2 催化剂积碳 氧气会与积碳反应,从而消碳
【解析】
(1)依据化学方程式和题中所给的数据,计算出平衡时CH4、H2O、CO、H2的物质的量,计算出它们的物质的量分数以及出它们的分压,计算Kp;
(2)根据题中信息,甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,实现反应器中能量自给(不需要补充热量),即按一定的比例甲烷水蒸气重整制氢吸收的热量与甲烷氧化重整制氢放出的热量相等,进行相关计算;
CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,实现反应器中能量自给(不需要补充热量),即按一定的比例甲烷水蒸气重整制氢吸收的热量与甲烷氧化重整制氢放出的热量相等,进行相关计算;
(3)依据反应速率的定义,单位时间内甲烷浓度的变化量,计算出甲烷的反应速率,在计算的时候,注意单位之间的换算。
(1)根据题意,假设n(CH4)=xmol,n(H2O)=3x mol,甲烷转化率为![]() ,则
,则
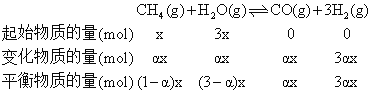
平衡时气体的总物质的量为(1-![]() )xmol+(3-
)xmol+(3-![]() )xmol+
)xmol+![]() xmol+3
xmol+3![]() xmol=(4+2
xmol=(4+2![]() )xmol,因为达到平衡时氢气的物质的量分数为0.3,即
)xmol,因为达到平衡时氢气的物质的量分数为0.3,即 ![]() ,
,![]() =0.5,所以平衡后的总物质的量为5x mol,平衡后n(CH4)=0.5xmol、n(H2O)=2.5xmol、n(CO)=0.5xmol、n(H2)=1.5x mol,平衡后CH4的分压为
=0.5,所以平衡后的总物质的量为5x mol,平衡后n(CH4)=0.5xmol、n(H2O)=2.5xmol、n(CO)=0.5xmol、n(H2)=1.5x mol,平衡后CH4的分压为![]() ,同一容器中 CH4、H2O、CO、H2分压之比等于物质的量之比,即p(CH4):p(H2O):p(CO):p(H2)= 0.5xmol:2.5xmol:0.5xmol:1.5x mol =1:5:1:3,所以p(H2O)=0.1Mpa、p(CO)=0.02Mpa,p(H2)=0.06Mpa,
,同一容器中 CH4、H2O、CO、H2分压之比等于物质的量之比,即p(CH4):p(H2O):p(CO):p(H2)= 0.5xmol:2.5xmol:0.5xmol:1.5x mol =1:5:1:3,所以p(H2O)=0.1Mpa、p(CO)=0.02Mpa,p(H2)=0.06Mpa,
![]() ;理论上水碳起始物质的量之比等于化学方程式中的化学计量数之比时,即水碳起始物质的量之比1:1,氢气的物质的量分数将达到最大;
;理论上水碳起始物质的量之比等于化学方程式中的化学计量数之比时,即水碳起始物质的量之比1:1,氢气的物质的量分数将达到最大;
(2)①将甲烷水蒸汽重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸汽约15:7:1体积比进料(空气中氧气体积分数约为0.2),则氧气、甲烷、水蒸汽约3:7:1体积比进料,令参加反应消耗氧气、甲烷、水蒸气的物质的量分别为3mol、7mol、1mol,
甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,令△H2=-y kJmol-1,结合方程式以及反应可以实现反应器中能量自给(不需要补充热量),故有1mol CH4、1mol H2O(g)参加甲烷水蒸气重整制氢吸收的热量为216kJ;6mol CH4、3mol O2参加氧化重整制氢,故3y=216,y=72,所以甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=-72kJmol-1;
CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,令△H2=-y kJmol-1,结合方程式以及反应可以实现反应器中能量自给(不需要补充热量),故有1mol CH4、1mol H2O(g)参加甲烷水蒸气重整制氢吸收的热量为216kJ;6mol CH4、3mol O2参加氧化重整制氢,故3y=216,y=72,所以甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=-72kJmol-1;
②实际生产中,空气、甲烷、水蒸汽按照约1:1:2体积比进料,增加水蒸气的作用是提高甲烷的转化率,另外甲烷水蒸气重整制氢、甲烷氧化重整制氢生成的CO能与水蒸气反应生成H2,其反应方程式为CO+H2O ![]() CO2+H2;
CO2+H2;
(3)甲烷水蒸汽重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,![]() ,2-5s甲烷质量分数由7.32%变为5.32%,所以2-5s甲烷质量减少量为16×(7.32%-5.32%)
,2-5s甲烷质量分数由7.32%变为5.32%,所以2-5s甲烷质量减少量为16×(7.32%-5.32%)![]() 3=0.96g,2-5s甲烷变化的物质的量为
3=0.96g,2-5s甲烷变化的物质的量为
![]() ,
,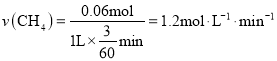 ;随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定, CH4
;随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定, CH4![]() C+2H2,生成的碳覆盖在催化剂表面,使催化剂中毒;氧气会消耗催化剂表面的积碳,故将甲烷水蒸汽重整和甲烷氧化重整两种方法结合能处理催化剂表面的积碳。
C+2H2,生成的碳覆盖在催化剂表面,使催化剂中毒;氧气会消耗催化剂表面的积碳,故将甲烷水蒸汽重整和甲烷氧化重整两种方法结合能处理催化剂表面的积碳。


科目:高中化学 来源: 题型:
【题目】某探究学习小组用一定量的乙醇和钠反应推测乙醇结构,实验装置图如图所示.关于实验操作或叙述错误的是

A.实验时应保证乙醇足量,让钠反应完全
B.装置b中进气导管不应插入水中,排水导管应插到集气瓶底部
C.通过测定放出氢气气体的体积计算乙醇中活泼氢的数目,从而推测乙醇的结构
D.从量筒中读取排除出水的体积时,应注意上下移动量筒使量筒内的液面与集气瓶中的液面相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O![]() +CO2+H2O→2C6H5OH+CO32-
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO![]() +OH-=SO32-+H2O
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO![]() +6H+= 518O2+2Mn2++8H2O
+6H+= 518O2+2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基二茂铁常用作火箭燃料添加剂、汽油抗爆剂等。某兴趣小组制备乙酰基二茂铁,流程如下:

已知:
a.反应原理:![]() +(CH3CO)2O
+(CH3CO)2O![]() CH3COOH+
CH3COOH+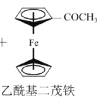
b.二茂铁熔点173℃,沸点249℃,100℃易升华。
c.乙酰基二茂铁熔点81℃,沸点163℃。不溶于水,易溶于有机溶剂。
请回答:
(1)步骤I,在50 mL圆底烧瓶中,加入新制的、经提纯后0.5 g二茂铁,5 mL乙酸酐,在振摇下滴入1 mL 85%磷酸,提纯二茂铁的方法为_______________。
(2)步骤II,加料毕,用装填有CaCl2的干燥管塞住圆底烧瓶瓶口。如图所示,其目的是__________。

(3)步骤IV,反应完毕后,将紫色混合物倾入含40 g碎冰烧杯中,并用10 mL冷水洗涤烧瓶,将洗涤液并入烧杯,在搅拌下加入NaHCO3(s),判断溶液呈中性的实验方法为__________。
(4)步骤V,包括结晶、吸滤、洗涤、干燥等多步操作。下列说法正确的是__________。
A.为较快地析出晶体,可以用玻璃棒摩擦烧杯内壁
B.吸滤装置由吸滤瓶、布氏漏斗、抽气泵组成
C.宜用乙醇洗涤,洗涤后乙醇易挥发
D.可在100℃红外灯下干燥
(5)①粗产品中含有杂质为___________,可以用来鉴别的仪器是___________。
②分离提纯粗产品后,用薄层层析来测定Rf值。选出其正确操作并按序列出字母:a→c→_______→_______→________→_________→g。
a.制备薄层色谱板
b.用少量纯二茂铁和提纯后的产品分别溶于2 mL甲苯中,配成浓溶液
c.用细玻璃管拉制两根微量滴管(尖端处约0.7mm)
d.将色谱板插入盛有乙醚的槽内,盖上盖子
e.待溶剂上升到色谱板3/4高度时,取出色谱板,并标记溶剂所到高度
f.分别用微量滴管浸入两浓溶液,在色谱板两原点处点样,待干燥后,再重复点样
g.计算Rf值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
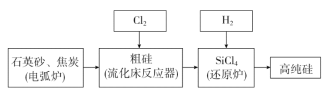
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
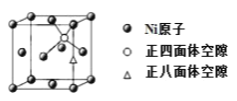
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 gcm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com