
【题目】PCl3和Cl2在一定条件下反应生成PCl5。
(1)有88 g CO2与足量H2恰好完全反应,生成气态水和甲醇,可放出1.2014×105 J的热量,试写出该反应的热化学方程式_______________________________________。
(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,9 g液态水变为水蒸气吸热b kJ,则CH4燃烧生成二氧化碳和水蒸气热化学方程式为________________________________。
(3)硅与氯两元素的单质反应生成1mol硅的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________________________________________。
(4)CO2与CH4经催化重整制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=________________________________。
(5)利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________________________________。
【答案】CO2(g)+3H2(g)=CH3OH(g)+H2O(g);H=-60.07 kJ/mol CH4(g)+2O2(g)===CO2(g)+2H2O(g);H=-(a-4b)kJ/mol Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol +120 kJ·mol-1 3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1
2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1
【解析】
(1)88gCO2的物质的量是2mol,2molCO2与足量H2恰好完全反应,生成气态水和甲醇,放出1.2014×105 J的热量,则1molCO2参与反应放热60.07 kJ;(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,则甲烷燃烧热的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -akJ/mol;9 g液态水变为水蒸气吸热b kJ,则H2O(l)= H2O(g) H= 2b kJ/mol;根据盖斯定律计算CH4燃烧生成二氧化碳和水蒸气的焓变;(3)硅与氯两元素的单质反应生成SiCl4,SiCl4熔、沸点分别为-69℃和58℃,则常温下呈液态,生成1mol 液态SiCl4放热687kJ;(4)焓变=反应物的总键能-生成物的总键能;(5) 反应Ⅱ是3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s),根据盖斯定律计算反应Ⅱ的焓变。
2H2SO4 (l)+S(s),根据盖斯定律计算反应Ⅱ的焓变。
(1)88gCO2的物质的量是2mol,2molCO2与足量H2恰好完全反应,生成气态水和甲醇,放出1.2014×105 J的热量,则1molCO2参与反应放热60.07 kJ;该反应的热化学方程式是CO2(g)+3H2(g)=CH3OH(g)+H2O(g);H= -60.07 kJ/mol;(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,则甲烷燃烧热的热化学方程式是 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -akJ/mol;9 g液态水变为水蒸气吸热b kJ,则②H2O(l)= H2O(g) H=2b kJ/mol;根据盖斯定律①-2×②得CH4燃烧生成二氧化碳和水蒸气的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(g);H= -(a-4b) kJ/mol;(3)硅与氯两元素的单质反应生成SiCl4,SiCl4熔、沸点分别为-69℃和58℃,则常温下呈液态,生成1mol 液态SiCl4放热687kJ,热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol;(4)焓变=反应物的总键能-生成物的总键能,所以CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g) ΔH=413kJ/mol×4+745kJ/mol×2-1075kJ/mol×2-436kJ/mol×2=+120 kJ·mol-1;(5) ① 2H2SO4(l)
2CO (g)+ 2H2(g) ΔH=413kJ/mol×4+745kJ/mol×2-1075kJ/mol×2-436kJ/mol×2=+120 kJ·mol-1;(5) ① 2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1;②S(s)+O2(g)
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1;②S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1;根据盖斯定律-①-②得反应Ⅱ的热化学方程式为3SO2(g)+2H2O (g)
SO2(g) ΔH3=-297 kJ·mol-1;根据盖斯定律-①-②得反应Ⅱ的热化学方程式为3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1。
2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。现将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______________________ ;
当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
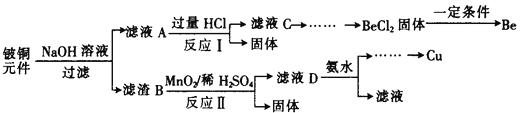
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10![]() Ksp[Fe(OH)3]=4.0×10
Ksp[Fe(OH)3]=4.0×10![]() Ksp[Mn(OH)2]=2.1×10
Ksp[Mn(OH)2]=2.1×10![]()
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式),
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________。
(2)溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序___________。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是________________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
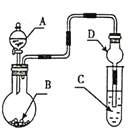
A. 若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B. 实验仪器D可以起到防止溶液倒吸的作用
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液中先产生白色沉淀,然后沉淀又溶解
D. 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石是一种古老的玉料,常与其它含铜矿物共生(蓝铜矿、辉铜矿、赤铜矿、自然铜等),主要成分是Cu(OH)2CuCO3,含少量FeCO3及硅的氧化物。实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

已知:Fe3+在水溶液中存在Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有________。
(2)步骤I所得沉淀主要成分的用途为________。
(3)步骤Ⅱ中试剂①是____________(填代号)
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:________。
(4)请设计实验检验溶液3中是否存在Fe3+:___________。
(5)测定硫酸铜晶体(CuSO4xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=______(计算结果精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
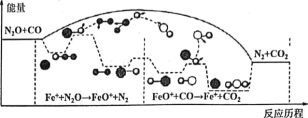
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系不正确的是
A. pH相等的 NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B. 0.1mol·L-1的NaOH溶液与0.2mol·L-1的HA溶液等体积混合,所得溶液呈碱性:c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+)
C. 25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH-)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-)
D. 已知25℃时Ksp(AgCl)=1.8×10-10,则在该温度下0.3 mol·L -1NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com