
����Ŀ���о�����CO��N2O��Fe+�����·�����Ӧ�������仯����Ӧ������ͼ��ʾ��������Ӧ�քeΪ����N2O+Fe+=N2+FeO (��������FeO++CO=CO2+Fe+ (�죩������˵����ȷ����
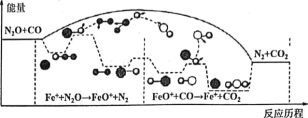
A. ��Ӧ����������ԭ��Ӧ����Ӧ���Ƿ�������ԭ��Ӧ
B. ������Ӧ��Ϊ���ȷ�Ӧ���ܷ�Ӧ�Ļ�ѧ��Ӧ�����ɷ�Ӧ�ھ���
C. Fe+ʹ��Ӧ�Ļ�ܼ�С��FeO+���м����
D. ��ת��lmol���ӣ�������II.2LN2O
���𰸡�C
��������
A.��Ӧ�����ھ���Ԫ�ػ��ϼ۵���������˶���������ԭ��Ӧ��A����
B.��ͼ��֪��Fe++N2O��FeO++N2��FeO++CO��Fe++CO2�����о�Ϊ��Ӧ������������������������������������Ӧ���Ƿ��ȷ�Ӧ���ܷ�Ӧ�Ļ�ѧ��Ӧ�������������ķ�Ӧ�پ�����B����
C. Fe+��������ʹ��Ӧ�Ļ�ܼ�С��FeO+�Ƿ�Ӧ�����в��������ʣ�������м���C��ȷ��
D.����û��ָ��������������Բ���ȷ������������D����
�ʺ���ѡ����C��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӡ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺
(1)����M�ľ�����ԭ�Ӽ�ͨ��______________________�����γ����������ܶѻ�������Mԭ�ӵ���λ��____________��
(2)Ԫ��Y�ĺ������У�������ǿ����________________��д��ѧʽ������������ӵ����幹��Ϊ______________________��
(3)M��Y�γɵ�һ�ֻ����������������ͼ��ʾ��
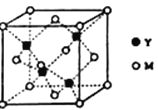
�ٸû�����Ļ�ѧʽΪ______________________����֪��������a=0.542 nm���˾�����ܶ�Ϊ__________________________g��cm�C3����ֻд������ʽ�������ӵ�����ΪNA��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ���ǣ�_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCl3��Cl2��һ�������·�Ӧ����PCl5��
(1)��88 g CO2������H2ǡ����ȫ��Ӧ��������̬ˮ�ͼ״����ɷų�1.2014��105 J����������д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________________��
(2)25 ����101 kPa�£�CH4��ȼ����Ϊa kJ/mol��9 gҺ̬ˮ��Ϊˮ��������b kJ����CH4ȼ�����ɶ�����̼��ˮ�����Ȼ�ѧ����ʽΪ________________________________��
(3)��������Ԫ�صĵ��ʷ�Ӧ����1mol�����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69���58�棬д���÷�Ӧ���Ȼ�ѧ����ʽ��________________________________________________��
(4)CO2��CH4���������Ƶúϳ�����CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)��֪������Ӧ����صĻ�ѧ�������������£�
2CO (g)+ 2H2(g)��֪������Ӧ����صĻ�ѧ�������������£�
��ѧ�� | C��H | C=O | H��H | C |
����/kJ��mol1 | 413 | 745 | 436 | 1075 |
��÷�Ӧ����H=________________________________��
(5)���ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��Ӧ����2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ����S(s)+O2(g)![]() SO2(g) ��H3=��297 kJ��mol��1
SO2(g) ��H3=��297 kJ��mol��1
��Ӧ����Ȼ�ѧ����ʽ��___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2�ǻ�����ѧ�о����ȵ���⣬�Ǽ�������ЧӦΣ������Ҫ;����
(1)��ҵ�ϣ�������Ȼ���������̼��Ӧ�Ʊ��ϳ���(CO��H2)����ѧ����ʽΪCO2(g)+CH4(g)��2CO(g)+2H2O(g)������Ӧ�������仯��ͼ1��ʾ���÷�Ӧ��________(����ȷ�Ӧ�����ȷ�Ӧ������

(2)��ҵ����CO2�����״�(CH3OH)ȼ�ϣ����Խ�CO2���Ϊ���������Ϊ1L���ܱ������У�����1molO2��4molH2��һ�������·�-��Ӧ��CO2(g)+3H2(g)��CH3OH(g)+H2O(g)�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬��CH3OH��ʾ��ƽ����Ӧ����Ϊ______��
������ӦCO2(g)+3H2(g)��CH3OH(g)+H2O(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
A.v(H2)=0.01molL-1s-1 B.v(CO2)=0.15molL-1s-1
C.v(CH3OH)=0.3molL-1min-1 D.v(H2O)=0.45molL-1min-1
�÷�Ӧ�����ɿ쵽����˳��Ϊ______(����ĸ����
������������˵����Ӧ�ﵽ����ȵ���_______(����ĸ����
A.���������ܶȱ��ֲ���
B.���������CH3OH���������ԼΪ21.4%
C.�����������������ֲ���
D.H2��CH3OH����������֮��Ϊ3��1
(3)�״�(CH3OH)��һ�ֿ�������Դ�����й����Ŀ�����Ӧ��ǰ�����Լ״���������KOH��ҺΪԭ�ϣ�ʯīΪ�缫���������ֻ���أ��״���______����Ӧ���缫��ӦʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ�����з�Ӧ��ƽ�ⳣ�����£�
��N2(g)��O2(g)![]() 2NO(g) K1��1��10-30
2NO(g) K1��1��10-30
��2H2(g)��O2(g)![]() 2H2O(g) K2��2��1081
2H2O(g) K2��2��1081
��2CO2(g)![]() 2CO(g)��O2(g) K3��4��10-92
2CO(g)��O2(g) K3��4��10-92
����˵����ȷ����
A��NO�ֽⷴӦNO(g)![]()
![]() N2(g)��
N2(g)��![]() O2(g)��ƽ�ⳣ��Ϊ1��10-30
O2(g)��ƽ�ⳣ��Ϊ1��10-30
B������K2��ֵ�����жϳ�����H2��O2������Ӧ����H2O
C�������£�NO��H2O��CO2�������ʷֽ�ų�O2������˳��ΪNO>H2O>CO2
D���¶����ߣ�����������Ӧ��ƽ�ⳣ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��ӦA(g����3B(g��![]() 2C(g����2D(g���������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ����
2C(g����2D(g���������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ����
�ֱ����£����з�Ӧ������������ ��
A��v(C����0.04 mol/(L��s��
B��v(B����0.06 mol/(L��min��
C��v(A����0.15 mol/(L��min��
D��v(D����0.01 mol/(L��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��+B��g��![]() C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣮
C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣮

��1���÷�Ӧ��_________��Ӧ������ȡ��������ȡ�����
��2������Ӧ�ﵽƽ��ʱ�������¶ȣ�A��ת����_______�����������С���������䡱����
��3����Ӧ��ϵ�м�������Է�Ӧ���Ƿ���Ӱ�죿_____����С������ޡ�����ԭ����____��
��4���ڷ�Ӧ��ϵ�м����������Ӧ��������E1�ı仯�ǣ�E1____�����������С���������䡱����
�����Ȼ���(PCl5)���л��ϳ�����Ҫ���Ȼ��������������Ȼ���(PCl3)�Ȼ��õ���PCl3(g)+Cl2(g) ![]() PCl5(g) ��H=��0.930 kJmol-1 ��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0 mol PCl3��1.0 mol Cl2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
PCl5(g) ��H=��0.930 kJmol-1 ��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0 mol PCl3��1.0 mol Cl2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
��1��50~150s�ڵ�ƽ����Ӧ����v(PCl3)=___________��
��2�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ������ֵΪ___________��
��3����Ӧ��250sʱ���÷�Ӧ�ų�������Ϊ______________kJ��
��4�����й���������Ӧ��˵���У���ȷ����__________������ĸ��ţ���
a�������Ƿ��ƽ��״̬�����������ܶ�ʼ�ղ���
b��300sʱ�������¶ȣ������淴Ӧ����ͬʱ����
c��350sʱ������ܱ������г��뵪����ƽ��������Ӧ�����ƶ�
d����ͬ�����£�����ʼ����ܱ������г���1��2molPCl3��0��5molCl2 ��0��15mol PCl5����Ӧ������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����(����)
A.  ��ʹ��ˮ�����Ը��������Һ��ɫ
��ʹ��ˮ�����Ը��������Һ��ɫ
B. ��ȼ�շ������Ҵ����������Ȼ�̼
C. ��֬������ܶ࣬������ˮ���һ����һ������ͬ
D. ��������Һ�м��뼸��ϡ���ᣬˮԡ���ȼ����ӣ��ټ�������������Һ��ˮԡ���ȣ�����������ˮ�������л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵ������������Ǵ�����������3���������������������������֮��С��10����Ԫ��Ϊ( )
A. �B. ��C. ��D. ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com