
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
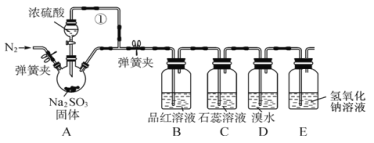
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
【答案】分液漏斗 H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O 平衡气压,便于浓硫酸顺利滴下 溶液褪色 还原 吸收SO2气体,防止污染空气 2OH-+SO2=SO32-+H2O(或OH-+SO2=HSO3-)
【解析】
在装置A中用浓硫酸与亚硫酸钠反应制取SO2,用B中的品红溶液检验SO2的漂白性,在C中检验其水溶液的酸性,在D中检验其还原性,由于SO2是大气污染物,因此用E的NaOH溶液进行尾气处理。
(1) 装置A中用于添加浓硫酸的仪器名称为分液漏斗;装置A中的浓硫酸和亚硫酸钠发生复分解反应,生成SO2、硫酸钠和水,反应的化学方程式为 H2SO4+Na2SO3=Na2SO4+SO2↑+H2O;
(2)反应产生气体,使烧瓶内的气压变大,若没有导管①平衡压强,分液漏斗内液体不能够顺利流下,所以导管①的作用是平衡气压,便于浓硫酸顺利滴下;
(3)在D中二氧化硫与溴水发生氧化还原反应生成硫酸和HBr,反应为SO2+Br2+2H2O=2HBr+H2SO4,溶液变为无色,其中SO2中S元素的化合价升高,说明SO2具有还原性;
(4)SO2有毒,会污染空气,根据其是酸性氧化物,能够与碱反应,产生可溶性盐的性质,常用NaOH溶液吸收处理,反应化学方程式为2NaOH+SO2=Na2SO3+H2O,即离子方程式为2OH-+SO2=SO32-+H2O,若SO2过量,则离子方程式为OH-+SO2=HSO3-。


科目:高中化学 来源: 题型:
【题目】A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-![]() D+E,据此回答下列问题:
D+E,据此回答下列问题:
(1)写出D的结构式___________,E的结构式___________。
(2)实验室制备D物质的反应方程式________。
(3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。
(4)B、F两元素组成的原子数目比为1:1的化合物的电子式___________、该物质中存在的化学键有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
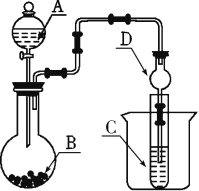
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分条件已略去)。 A为海水中含量最高的盐类物质, C 为黄绿色气体, F为生活中常见的金属单质, I为红褐色沉淀。

(1)E的化学式为_____,I的名称为_______;
(2)写出D的电子式_______;
(3)写出反应①的化学方程式:______;写出反应⑤的离子方程式:_________。
(4)检验H溶液中金属阳离子的方法是_____________。
(5)保存G溶液时要加少量固体 F 的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
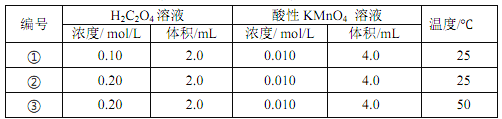
下列说法不正确的是
A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 若实验①测得 KMnO4溶液的褪色时间为 40 s, 则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol/L/s
C. 实验①和实验②是探究浓度对化学反应速率的影响, 实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的 Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)①的元素符号为 _________;
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是______________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是______(用化学式表示)。
(5)①和⑧形成化合物的电子式为_________________
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应至第2分钟X、Y、Z的物质的量不再变化,Y所占的体积分数为_____。
(2)该反应的化学方程式为_______________________________________________
(3)反应开始至2min,气体Z的平均反应速率为____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com