
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)①的元素符号为 _________;
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是______________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是______(用化学式表示)。
(5)①和⑧形成化合物的电子式为_________________
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
【答案】C Cl HF HClO4 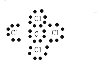 Al(OH)3 + OH =AlO2 + 2H2O
Al(OH)3 + OH =AlO2 + 2H2O
【解析】
由元素在周期表的位置可知:①为C元素,②为O元素,③为F元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,据此答题。
由分析可知:①为C元素,②为O元素,③为F元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素。
(1)由分析可知:①为碳元素,元素符号为C,故答案为:C。
(2)同一周期元素的原子,从左向右原子半径逐渐减小,所以第3周期主族元素中,原子半径最小的是Cl,故答案为:Cl。
(3)元素的非金属性越强,氢化物越稳定,表中非金属性最强的是F,所以气态氢化物中最稳定的是HF,故答案为:HF。
(4)①为C元素,②为O元素,⑦为S元素,⑧为Cl元素,元素的非金属性越强,最高价氧化物的水化物的酸性越强,这四中元素中非金属性最强的是Cl,故最高价氧化物的水化物中酸性最强的是HClO4,故答案为:HClO4。
(5)①为C元素、⑧为Cl元素,①和⑧形成化合物为CCl4,CCl4是由非金属形成的共价化合物,电子式为: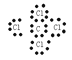 ,故答案为:
,故答案为: 。
。
(6)④为Na元素、⑥为Al元素,Na和Al的最高价氧化物的水化物分别为NaOH、Al(OH)3,NaOH与Al(OH)3反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH =AlO2+2H2O,故答案为:Al(OH)3+OH=AlO2+2H2O。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:![]() 叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
A. 狄尔斯阿德而反应为加成反应,原子利用率为100%
B. ![]() 可通过狄尔斯阿德而反应合成,而
可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成
不可通过狄尔斯阿德而反应合成
C. 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种
D. ![]() 可由环戊二烯与丙烯酸甲酯发生上述反应得到
可由环戊二烯与丙烯酸甲酯发生上述反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
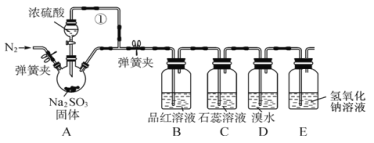
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X常温下为气体, a、b、c 是中学化学常见物质, 均由常见元素组成, 转化关系(反应条件略去)如图所示, 下列说法不正确的是

A. 若 b 为固态非金属单质,b 与 X 所含元素同主族,则c也能与 X 反应
B. 若 X 为 O2,a 为一种固态单质,则c可能为CO2或 SO3
C. 若 a、b、c 焰色反应均呈黄色,水溶液均呈碱性,则a中可能既含有离子键又含有共价键
D. 若 b 为气态非金属单质,b 与 X 所含元素同周期,则 X 与 b 所含元素原子的核电荷数相差1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的有机物A有下列变化关系:

其中B、C的相对分子质量相等,下列有关说法不正确的是
A. C和E酸化后得到的有机物互为同系物 B. 符合题目条件的A共有4种
C. D既能发生氧化反应,又能发生还原反应 D. 符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。

A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
__Fe(OH)3 +__ClO-+_OH-=_FeO42-+_Cl-+_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com