
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×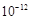
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
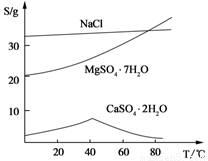
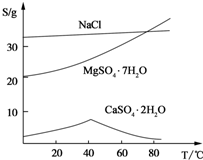
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
(15分)
(1)提高Mg2+的浸取率(2分)
(2)8(2分)
(3)温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小)(2分)
Al(OH)3 、Fe(OH)3 、CaSO4·2H2O (2分)
(4)NaOH溶液(2分) 向沉淀中加足量稀硫酸(2分)
(5)20.0%(3分)
【解析】
试题分析:由流程图,①②③酸浸,溶解,④分离溶液和固体杂质,主要是H2SiO3和不溶解的滤渣,⑤将Fe2+ 氧化成Fe3+ 以便分步除去,⑥分离Fe (OH)3 、Al
(OH)3 和MgSO4、NaCl溶液,由滤液Ⅱ得到产品。⑴通过煮沸提高反应速率,提高Mg2+ 的浸出率,答案:提高Mg2+的浸取率;⑵Ksp[Mg(OH)2]=6.0×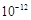 =c(Mg2+ )c2(OH― )得:c2(OH― )= 6.0×
=c(Mg2+ )c2(OH― )得:c2(OH― )= 6.0×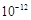 /6=1.0×10-12,c(OH―
)=1.0×10―6mol/L,PH
/6=1.0×10-12,c(OH―
)=1.0×10―6mol/L,PH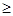 8,答案:8;⑶从图中读出高温下CaSO4·2H2O溶解度小,与溶液分离更彻底,答案:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小); Al(OH)3 、Fe(OH)3
、CaSO4·2H2O;⑷滤液Ⅱ中含有MgSO4、NaCl,要将NaCl分离出去,要先将Mg2+ 形成Mg(OH)2 沉淀,过滤后将NaCl除去,然后加H2SO4重新生成MgSO4,然后蒸发浓缩,降温结晶,过滤、洗涤、干燥后获得晶体。答案:NaOH溶液;向沉淀中加足量稀硫酸;⑸MgSO4·7H2O质量为24.6 g,是0.1mol,则0.1molMg (OH)2
为5.8 g,5.8g/29g×100%=20.0%。答案:20.0%。
8,答案:8;⑶从图中读出高温下CaSO4·2H2O溶解度小,与溶液分离更彻底,答案:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小); Al(OH)3 、Fe(OH)3
、CaSO4·2H2O;⑷滤液Ⅱ中含有MgSO4、NaCl,要将NaCl分离出去,要先将Mg2+ 形成Mg(OH)2 沉淀,过滤后将NaCl除去,然后加H2SO4重新生成MgSO4,然后蒸发浓缩,降温结晶,过滤、洗涤、干燥后获得晶体。答案:NaOH溶液;向沉淀中加足量稀硫酸;⑸MgSO4·7H2O质量为24.6 g,是0.1mol,则0.1molMg (OH)2
为5.8 g,5.8g/29g×100%=20.0%。答案:20.0%。
考点:综合实验题,涉及元素化合物知识、氧化还原滴定、指示剂选择、误差分析、实验步骤、pH调节等多方面内容,考查学生对综合实验处理能力。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省焦作市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:

用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
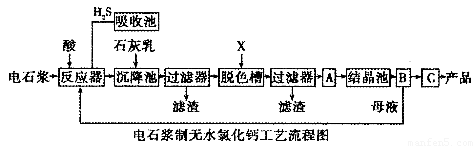
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
A.水??????? B.浓硫酸???????? C.石灰乳????????? D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是_______________________。
(5)氯碱工业电极方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com