

 mol/L=10-6mol/L,所以氢离子浓度为10-8mol/L,pH为8,故答案为:8;
mol/L=10-6mol/L,所以氢离子浓度为10-8mol/L,pH为8,故答案为:8;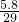 ×100%=20%,故答案为:20.0%.
×100%=20%,故答案为:20.0%.

科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:实验题
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×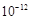
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
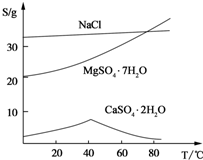
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
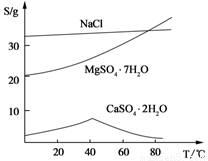
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com