
X��Y��Z��W��Ԫ�����ڱ�ǰ�������е����ֳ���Ԫ�أ��������Ϣ���±���
| Ԫ�� | �����Ϣ |
| X | X�Ļ�̬ԭ�Ӻ���3���ܼ����е��ӣ���ÿ���ܼ��ϵĵ�������� |
| Y | ���³�ѹ�£�Y�����ǵ���ɫ���壬���ڻ�ɽ�ڸ������� |
| Z | Z��Yͬ����,Z�ĵ縺�Դ���Y |
| W | W��һ�ֺ��ص�������Ϊ63��������Ϊ34 |
��1��Yλ��Ԫ�����ڱ������������ڱ��������壬Y��Z������������Ӧ��ˮ��������Խ�ǿ������������������д��ѧʽ����
��2��XY2��һ�ֳ��õ��ܼ���XY2�ķ����д������������Ҽ�����H�DY��H�DZ���ֹ��ۼ��У����ļ��Խ�ǿ�������������������ϳ�����������������
��3��W�Ļ�̬ԭ�Ӻ�������Ų�ʽ��������������������������W2Y�ڿ�������������W2O�Ļ�ѧ����ʽ������������������ ��������������
��4��������XO��YO2�̵�����Ⱦ��һ�ַ������ǽ����ڴ���������ת��Ϊ����Y��
��֪��XO(g)+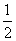 O2(g)=XO2(g)
O2(g)=XO2(g)  H=��283.0 kJ��mol��2
H=��283.0 kJ��mol��2
Y(g)+ O2(g)=YO2(g)  H=��296.0 kJ��mol��1
H=��296.0 kJ��mol��1
�˷�Ӧ���Ȼ�ѧ����ʽ������������������������������������������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�10 mL 0.40 mol/L H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�����(������Ϊ��״��)���±���
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ����(��Һ����仯���Բ���)(����)
A��0��6 min��ƽ����Ӧ���ʣ�
v(H2O2)��3.3��10��2mol��L��1��min��1
B��0��6 min��ƽ����Ӧ���ʣ�
v(H2O2)<3.3��10��2mol��L��1��min��1
C����Ӧ��6 minʱ��c(H2O2)��0.30 mol/L
D����Ӧ��6 minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ѣ�CH3OCH3������ɫ���壬����Ϊһ��������Դ���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ�������Ҫ���̰��������ĸ���Ӧ��
�״��ϳɷ�Ӧ��
��CO(g��+ 2H2(g)��CH3OH(g) ��H1=-90.1 kJ��mol-1
��CO2(g)+ 3H2(g)��CH3OH(g)+H2O(g) ��H2=-49.0 kJ��mol-1
ˮú���任��Ӧ��
��CO(g) + H2O (g)��CO2(g)+H2(g) ��H3=-41.1 kJ��mol-1
�����Ѻϳɷ�Ӧ��
��2CH 3OH(g)��CH3OCH3(g)+H2O(g) ��H4=-24.5 kJ��mol-1
3OH(g)��CH3OCH3(g)+H2O(g) ��H4=-24.5 kJ��mol-1
��Al2O3�Ǻϳ���ֱ���Ʊ������ѷ�Ӧ��������Ҫ�ɷ�֮һ����ҵ�ϴ��������Ʊ��ϸߴ���Al2O3����Ҫ���������� ���Ի�ѧ����ʽ��ʾ�� ��
�Ʒ����� ���Ѻϳɷ�Ӧ�ܶ���COת���ʵ�Ӱ�� ��
���Ѻϳɷ�Ӧ�ܶ���COת���ʵ�Ӱ�� ��
����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ ��
�����о����ڴ�������Cu-Zn-Al-O��Al2O3����ѹǿΪ5.0MPa����������H2��COֱ���Ʊ������ѣ��������ͼ��ʾ������COת�������¶����߶����͵�ԭ����____________��

�ɶ�����ֱ��ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������ܶȸ��ڼ״�ֱ��ȼ��ȼ�ϵ�أ�5.93kW��h��kg-1�����������Ϊ���ԣ�������ֱ��ȼ�ϵ�صĸ�����ӦΪ_______________��
һ�������ѷ��Ӿ����绯ѧ���������Բ���_______�����ӵĵ������õ�����������ѹ1.20V�������ܶ�E=_____����ʽ���㣬�����ܶ�=����������/ȼ��������1kW��h=3.6��105J ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Ӧ�ġ�H=+100kJ��mol-1�������йظ÷�Ӧ��������ȷ����
A.����Ӧ���С��100kJ��mol-1
B.�淴Ӧ���һ��С��100kJ��mol-1
C.����Ӧ��ܲ�С��100kJ��mol-1
D.����Ӧ��ܱ��淴Ӧ��ܴ�100kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��298K��100kPaʱ����֪��2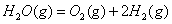 �S
�S
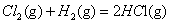 �S
�S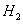
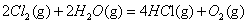 �S
�S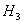
��S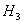 ��S
��S �ͨS
�ͨS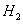 ��Ĺ�ϵ��ȷ����
��Ĺ�ϵ��ȷ����
A .�S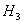 =�S
=�S +2�S
+2�S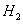 B �S
B �S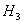 =�S
=�S +�S
+�S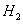
C. �S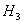 =�S
=�S -2�S
-2�S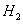 D. �S
D. �S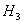 =�S
=�S - �S
- �S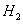
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±��г���3��ȼú����������ԭ����
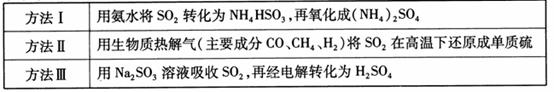
��1�� �������а�ˮ����ȼú������ �Ļ�ѧ��ӦΪ��
�Ļ�ѧ��ӦΪ��

�����ȼú������ ȥ���ʵĴ�ʩ�� �� ������ĸ����
ȥ���ʵĴ�ʩ�� �� ������ĸ����
A������ˮŨ��
B.���߷�Ӧ�¶�
C.ʹȼú�����백ˮ��ֽӴ�
D. ͨ�����ʹ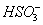 ת��Ϊ
ת��Ϊ
���÷�������������ҪԤ�ȳ�ȥȼú�����д����� ��ԭ�������������ӷ���ʽ��ʾ����
��ԭ�������������ӷ���ʽ��ʾ����
��2�� ��������Ҫ���������з�Ӧ��
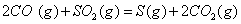
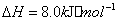


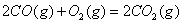
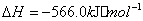



 ��
��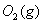 ��Ӧ����
��Ӧ����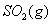 ���Ȼ�ѧ����ʽΪ ��
���Ȼ�ѧ����ʽΪ ��
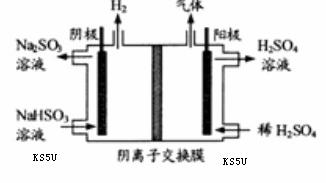
��3�� ���������ö��Ե缫���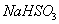 ��Һ��װ��
��Һ��װ��
����ͼ��ʾ���������ų�����ijɷ�Ϊ ��
���ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ʴʱ�������Ϸ����ķ�Ӧ�� ( )
A.2Fe-4e- =2Fe2+ B.2Fe2++4e- =2Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 �棬101 kPaʱ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3 kJ/mol�������ȼ����Ϊ5 518 kJ/mol�������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
A.2H+��aq��+ ��aq��+Ba2+��aq��+2OH-��aq��====BaSO4��s��+2H2O��l������H=-57.3 kJ/mol
��aq��+Ba2+��aq��+2OH-��aq��====BaSO4��s��+2H2O��l������H=-57.3 kJ/mol
B.KOH��aq��+ H2SO4��aq��====
H2SO4��aq��==== K2SO4��aq��+H2O��l������H=-57.3 kJ/mol
K2SO4��aq��+H2O��l������H=-57.3 kJ/mol
C.C8H18��l��+ O2��g��====8CO2��g��+9H2O��g������H=-5 518 kJ/mol
O2��g��====8CO2��g��+9H2O��g������H=-5 518 kJ/mol
D.2C8H18��g��+25O2��g��====16CO2��g��+18H2O��l������H=-5 518 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com