
【题目】有机物X的结构如图所示,下列说法正确的是

A.能使酸性高锰酸钾溶液褪色
B.X分子中含有2个手性碳原子
C.能与FeCl3溶液发生显色反应
D.1 mol X最多能与5 mol H2发生加成反应
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如图所示,下列说法正确的是( )
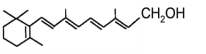
A.维生素A是一种易溶于水的醇
B.维生素A能被氧化得到酮
C.1mol维生素A最多能与5molH2发生加成反应
D.维生素A的分子式为C20H32O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 将SO2气体通入到Ba(NO3)2溶液中 | 生成白色沉淀 | 此沉淀是BaSO3 |
C | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
D | 燃烧的钠粒放入CO2中 | 燃烧且有白色和黑色颗粒产生 | 黑色颗粒是炭,白色颗粒可能是Na2CO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol·L-1的HCl标准溶液滴定20.00mL未知浓度的NaOH溶液,下列说法正确的是

A.可以用如图所示的装置及操作进行滴定
B.指示剂可以使用紫色石蕊
C.滴加盐酸的速度应保持匀速,且需不断摇荡锥形瓶
D.若滴加盐酸的滴定管滴定前有气泡,滴定终了无气泡,则所测NaOH溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中,正确的是
A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多
B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1
C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1
D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验原理或操作中,正确的是![]()
A.用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高
B.仰视量筒刻度量取一定量浓硫酸所配制的![]()
![]()
![]() 溶液的浓度结果偏低
溶液的浓度结果偏低
C.焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色
D.要将溶解在![]() 中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)发生两种裂解反应:
Ⅰ.CH3CH2CH2 CH2CH3 (g)CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=_________;向反应体系中充入一定量的水蒸气(水 蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将_____(填“增大”“减小”或“不变”),原因为_______________。
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3 的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。
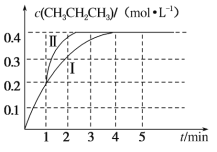
①ΔH3=_____。
②该反应的平衡常数 Kp=_____。(Kp 为以分压表示的平衡常数,分压=总压×物质的量分数,计算结果 保留 2 位小数)。
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为_____。
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为_____。
(4)以稀硫酸为电解质溶液,CH3CH3 燃料电池的负极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com