
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:___________________。

(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
若1molNH3还原NO至N2,则该反应过程中的热化学方程式:________。(用含a、b的式子表示ΔH3)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________________。
【答案】N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol 390 NH3(g)+![]() NO(g)=
NO(g)=![]() N2(g)+
N2(g)+![]() H2O(g),△H3=
H2O(g),△H3=![]() kJ·mol-1 2△H2-△H1
kJ·mol-1 2△H2-△H1
【解析】
(1)、先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
(2)、根据反应热等于反应物的总键能减去生成物的总键能计算;
(3)、利用盖斯定律计算;
(4)、利用盖斯定律计算。
(1)、反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46kJ热量,则反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
故答案为N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
(2)、反应热等于反应物的总键能减去生成物的总键能,设N- H的键能为x,则943kJ/mol+3×435kJ/mol-6x= -92kJ/mol,解得x= 390kJ/mol;
故答案为390;
(3)、已知①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
利用盖斯定律将①-3×②可得4NH3(g)+6NO(g)=5N2(g)+6H2O(g),△H=a-3b kJ·mol-1
故答案为NH3(g)+![]() NO(g)=
NO(g)=![]() N2(g)+
N2(g)+![]() H2O(g),△H3=
H2O(g),△H3=![]() kJ·mol-1
kJ·mol-1
(4)、根据反应反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3可知:反应Ⅲ=反应II×2-反应I,因此△H3 =2△H2-△H1;
2NH4HCO3(aq) ΔH3可知:反应Ⅲ=反应II×2-反应I,因此△H3 =2△H2-△H1;
故答案为2△H2-△H1。


科目:高中化学 来源: 题型:
【题目】化合物ZYX4是在化工领域有着重要应用价值的离子化合物,电子式如图所示。X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为金属元素,X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )

A.Z是短周期元素中金属性最强的元素
B.Y的最高价氧化物对应水化物呈弱酸性
C.X、Y可以形成分子式为YX3的稳定化合物
D.化合物ZYX4有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJmol-1
B. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知中和热为△H=-57.4kJmol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A. x=0.6a,2Br-+Cl2===Br2+2Cl-
B. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
C. x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D. x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
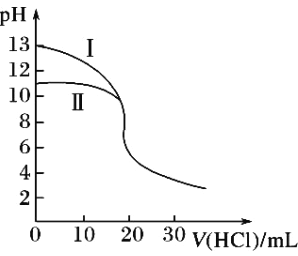
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol
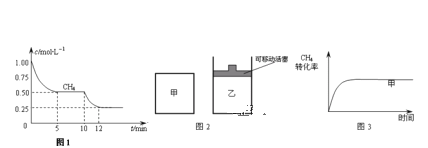
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=_____;10min时,改变的外界条件可能是________。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象_____。
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是____________(填代号)。
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 | 该物质一定属于醛类 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4溶液,当 2 mol电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 CuSO4溶液,当加入1 mol Cu(OH)2恢复电解前浓度时,电路中转移了4mol e-
C.将Mg、Al金属放在NaOH溶液中组成原电池,Mg做负极,Al做正极
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.24 g NaH中阴离子所含电子总数为NA
B.标准状况下,22.4 L苯中含有C—H键数目为6NA
C.在碳酸钠溶液中,若c(CO32-)=1mol/L,则c(Na+)=2mol/L
D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com