
【题目】在一密闭的2L的容器里装有4mol SO2和2mol O2 , 在一定条件下开始反应.2min末测得容器中共有5.2mol 气体,试计算:
(1)2min末SO3气体的物质的量浓度;
(2)2min内O2的平均反应速率v(O2);
(3)2min末SO2的转化率.
【答案】
(1)解:在一密闭的2L容器中装有4mol SO2和2mol O2,2min末测得容器中共有5.2mol 气体,设消耗的O2的物质的量为x,则利用三段式法进行计算:
2SO2(g)+ | O2(g) | 2 SO3(g) | |
起始量(mol) | 4 | 2 | 0 |
转化量(mol) | 2x | x | 2x |
2min末(mol) | 4-2x | 2-x | 2x |
4﹣2x+2﹣x+2x=5.2,解得x=0.8,则2min末SO3气体的物质的量2×0.8mol=1.6mol,
2min末SO3气体的物质的量浓度c(SO3)= ![]() =
= ![]() =0.8mol/L;
=0.8mol/L;
(2)解:2min内O2的物质的量的变化为:0.8mol,2min内O2的平均反应速率v(O2)= ![]() =
= ![]() =
= ![]() =0.2mol/(Lmin)
=0.2mol/(Lmin)
(3)解:2min末变化的SO2的物质的量为2×0.8mol=1.6mol,SO2的转化率= ![]() ×100%=
×100%= ![]() =40%
=40%
【解析】在一密闭的2L容器中装有4mol SO2和2mol O2 , 2min末测得容器中共有5.2mol 气体,设消耗的O2的物质的量为x,则利用三段式法进行计算
2SO2(g)+ | O2(g) | 2 SO3(g) | |
起始量(mol) | 4 | 2 | 0 |
转化量(mol) | 2x | x | 2x |
2min末(mol) | 4-2x | 2-x | 2x |
;(1)根据c= ![]() 计算SO3的浓度;(2)根据v=
计算SO3的浓度;(2)根据v= ![]() =
= ![]() 计算v(O2);(3)SO2的转化率=
计算v(O2);(3)SO2的转化率= ![]() ×100%.
×100%.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
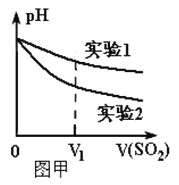
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
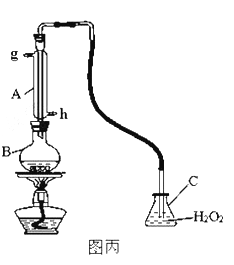
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A. 60 mL B. 45 mL C. 30 mL D. 50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题: 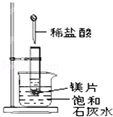
(1)写出试管内反应的离子方程式;
(2)实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ , 产生上述现象Ⅲ的原因是 .
(3)由实验推知,MgCl2溶液和H2的总能量(填“大于”、“小于”或“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A,B,C,D四种元素,A,B同周期,A,B可形成两种无色无味气体AB和AB2 . D在B的下一周期,其最高价氧化物的水化物是二元强酸,D,C可形成离子化合物CD,D离子比C离子多一个电子层.据此可知:
(1)这四种元素分别是A:_、B:、C:、D: .
(2)C离子的离子结构示意图是 .
(3)化合物CD的电子式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的可用于分离的实验方法是
A. 萃取 B. 蒸馏 C. 过滤 D. 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表(部分短周期元家的原子半径及主要化合价)信息,完成有关问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、﹣2 | ﹣2 |
(1)A、B、D、E的简单离子半径由大到小的顺序是(用具体离子符号表示);
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式;
(3)D和E组成的两种化合物中具有漂白性的是 , 该化合物转化为另一种化合物的化学方程式为;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构如下图所示,下列说法正确的是( )

A.一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2
B.一定条件下,1 mol A能和5 mol氢气发生加成反应
C.一定条件下,1 mol A能与3 mol NaOH反应
D.A能与碳酸氢钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com