
【题目】把aL含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用bmol烧碱刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗cmolBaCl2,则原溶液中c(NO3-)为( )
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 煤经过气化、液化等物理变化可转变为清洁燃料
B. 棉、麻、丝、有机玻璃都是天然高分子材料
C. PM2.5颗粒(微粒直径约为2.5×10-6m )分散在空气中形成气溶胶
D. 青铜、黄铜、碳素钢都属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分,根据A~M在周期表中的位置,回答下列问题:

(1)表中元素,化学性质最不活泼的是_______,氧化性最强的单质是________,还原性最强的单质是____。(写元素符号或化学式)
(2)表中元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式为________,酸性最强的化合物的化学式为___________,呈两性的化合物的化学式为___________。
(3)A分别与B、C、D、E、J、K、L、M形成的化合物中最稳定的是_______(写化学式)。
(4)写出D、G、L对应的离子半径由大到小的顺序________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气和水是人类生存和发展必不可少的自然资源,改善空气质量、合理利用水资源已成为全人类共识。
⑴今年9月以来北京地区发生严重雾霾天气,其中9月28日,各种污染物的污染指数为:二氧化硫86,二氧化氮71,可吸入颗粒物162,则该地区的空气污染指数为 ,首要污染物为 。
⑵汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为两种非污染性气体,写出该反应的化学反应方程式________________ 。
⑶明矾可用作废水处理的 剂,Al3+水解生成的 (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
⑷煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为 。(请写出其总反应方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据同分异构体的概念,判断下列物质互为同分异构体的是( )
A.CH3﹣CH2﹣CH3 和 CH3﹣CH2﹣CH2﹣CH3
B.NO和CO
C.CH3﹣CH2OH和 CH3﹣O﹣CH3
D.红磷和白磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+浓度最大的是
A. 0.5 L 0.8 mol·L-1的Na2SO4溶液
B. 2 L 1 mol·L-1的NaOH溶液
C. 1 L 1.2 mol·L-1的NaCl溶液
D. 3 L 0.5 mol·L-1的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaC1O、NaClO3的混合溶液,经测定,ClO-与ClO3-的物质的量浓度之比为1:3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是
A. 1: 4 B. 11:3 C. 3:1 D. 4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
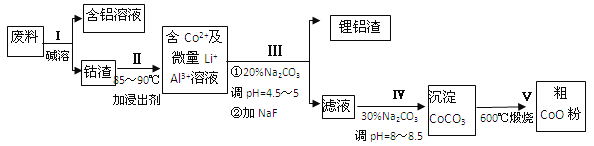
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com