
【题目】[化学-选修3:物质结构与性质]
(1)丙酮(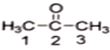 )分子中2号碳原子的杂化方式为__________;
)分子中2号碳原子的杂化方式为__________;
(2)写出镍原子的电子排布式_____________;
(3)H2O分子的键角比NH3分子的键角小,原因是_____________________________________ ;
(4)N、P、As属于同族元素,它们的简单氢化物沸点由大到小的顺序为_________________(用化学式表示),其原因是 ____________________________________;
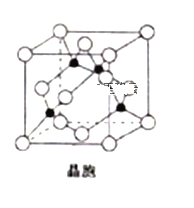
(5)由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
①将晶胞内的4个黑点相互连接所形成的立体构型是______________;
②晶体中与一个氯原子距离最近的氯原子有___________个;
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为____________pm(列出计算式即可);
【答案】sp2杂化 1s22s22p63s23p63d84s2或[Ar]3d84s2。 NH3中存在1对孤电子对,H2O中存在2对孤电子对,孤对子对数越多,和其他电子发生排斥作用越大,键角越小。 NH3>AsH3> PH3 NH3分子间有氢键,沸点最高,AsH3的相对分子质量比PH3大 正四面体型 12 (31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010
【解析】
(1)丙酮(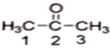 )分子中2号碳原子的杂化方式为sp2杂化。
)分子中2号碳原子的杂化方式为sp2杂化。
(2)镍元素原子核外有28个电子,电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2。
(3)NH3、H2O分子中心原子都是sp3杂化, NH3中存在1对孤电子对,H2O中存在2对孤电子对,孤对子对数越多,和其他电子发生排斥作用越大,键角越小。
(4)对于组成和结构相似的分子晶体,比较熔沸点大小时,先看有没有氢键, 没有氢键,再看相对分子质量,一般都是相对分子质量越大,熔沸点越高。
(5)①由该晶胞可以看出,与金刚石晶胞相似,所以晶胞内的四个黑点相互连接,可以组
成一个正四面体形。
②晶胞是孤立体系,周围有无数晶胞重叠,从底心的Cl看出,周围最近的原子有8个,下面一个晶胞有4个,因此在它周围最近的Cl有12个。
③设晶胞边长为acm,则一个晶胞的体积为a3cm3,一个晶胞中含有4个Cu,含有4个Cl,则1个晶胞的质量为m=(4×64+4×35.5)/NA g=(4×99.5/NA)g,因为密度为ρg.cm-3,所以晶胞边长a=[4×99.5/ (NA×ρ)]1/3cm;CuCl的晶胞与金刚石晶胞相似,所以该晶体中铜原子和氯原子之间的最短距离为体对角线的四分之一,即(31/2/4) ×[4×99.5/( NA×ρ)]1/3cm=(31/2/4) ×[4×99.5/( NA×ρ)]1/3×1010pm。
(1)丙酮中羰基碳原子与两个甲基碳原子和一个氧原子相连,丙酮( )分子中2号碳原子的杂化方式为sp2杂化,故答案为:sp2杂化。
)分子中2号碳原子的杂化方式为sp2杂化,故答案为:sp2杂化。
(2)镍元素原子核外有28个电子,电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2,故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2。
(3)NH3、H2O分子中心原子都是sp3杂化, NH3中存在1对孤电子对,H2O中存在2对孤电子对,孤对子对数越多,和其他电子发生排斥作用越大,键角越小,故答案为:NH3中存在1对孤电子对,H2O中存在2对孤电子对,孤对子对数越多,和其他电子发生排斥作用越大,键角越小。
(4)NH3分子间有氢键,氢键比分子间作用力大,所以沸点最高;对于组成和结构相似的分子晶体,相对分子质量越大,沸点越高,As的相对原子质量大于P,所以沸点:NH3>AsH3> PH3,故答案为:NH3>AsH3> PH3;NH3分子间有氢键,沸点最高,AsH3的相对分子质量比PH3大。
(5)①由该晶胞可以看出,与金刚石晶胞相似,所以晶胞内的四个黑点相互连接,可以组
成一个正四面体形,故答案为:正四面体型。
②晶胞不应作为孤立体系而存在,周围有无数晶胞重叠,从底心的Cl看出,周围最近的Cl原子有8个(4个顶点和邻近的4个面心),下面一个晶胞有4个(邻近的4个面心),因此在它周围最近的Cl有12个,故答案为:12。
③设晶胞边长为acm,则一个晶胞的体积为a3cm3,一个晶胞中含有4个Cu,含有4个Cl,则1个晶胞的质量为m=(4×64+4×35.5/NA)g=(4×99.5/NA)g,因为密度为ρg.cm-3,所以晶胞边长a=[4×99.5/ (NA×ρ)]1/3cm;CuCl的晶胞与金刚石晶胞相似,所以该晶体中铜原子和氯原子之间的最短距离为体对角线的四分之一,即:(31/2/4) ×(4×99.5/ NA×ρ)1/3cm=(31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010pm。故答案为:(31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010pm。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】恒温恒压条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:FeCl3、FeCl2、H2S、S、HCl,已知FeCl2为生成物,则另一生成物是
A. FeCl3 B. H2S C. S D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方程式为:CO2+2Mg=C+2MgO,该反应属于:①化合反应②分解反应③置换反应④复分解反应⑤氧化还原反应⑥离子反应⑦非氧化还原反应( )
A.①③⑦B.③⑤C.②③⑥D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果M、SO42-、Mg2+和Na+四种离子以物质的量之比为2∶4∶1∶2共同存在于同一种溶液中,那么M可能是
A. Ba2+ B. CO32- C. Cu2+ D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水里可以提取溴,主要反应为2Br﹣+Cl2=2Cl﹣+Br2,下列说法正确的是( )
A.溴离子具有氧化性B.氯气是还原剂
C.该反应属于复分解反应D.Br2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲苯的性质中,能说明苯环对侧链产生影响的是 ( )
A. 甲苯硝化生成三硝基甲苯
B. 甲苯能使酸性高锰酸钾溶液褪色
C. 甲苯与溴蒸汽混合光照可生成![]()
D. 甲苯与氢气可以发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com