
����Ŀ����������AlN����һ���ۺ������������մɲ��ϣ��ܻ���ˮ�⣬������ʴ��ijС��̽����ʵ�����Ʊ�AlN���ⶨ��Ʒ���ȣ����ʵ�����¡���ش�
���Ʊ�AlN
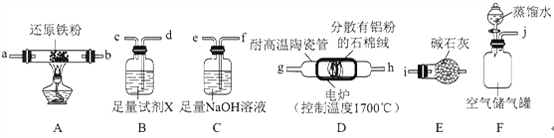
��1��ʵ��ʱ���Կ���Ϊԭ���Ʊ�AlN���������������ҵķ�������װ�õ���ȷ����˳��Ϊj��________��i���������ӿ���ĸ��ţ���
��2������װ���У���Ҫ��©����������Ϊ________��
��3���Լ�X������Ϊ________��
��4��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ________��
�ⶨ��Ʒ����
��5�����ʵ��֤����װ��D�IJ�Ʒ�к���Al����________��
��6���ⶨ��Ʒ���ȣ�ȡװ��D�в�Ʒ4.37g����������NaOHŨ��Һ��ͨ��ˮ�����������ɵ�����ȫ����������V1mLc1mol��L��1���������գ��Է�̪��ָʾ������c2mol��L��1��NaOH����Һ�ζ����������ᣬ�ﵽ�ζ��յ�ʱ������V2mLNaOH����Һ����
�ٴﵽ�ζ��յ������Ϊ________��
�ڲ�Ʒ��A1N����������Ϊ________���г�����ʽ���ɣ���
���𰸡� f e d c a b����b a��g h����h g�� ��Һ©�� ���տ����е�ˮ�������������뻹ԭ���۷�Ӧ����ʵ�� 2Al��N2![]() 2AlN ȡD��������Ʒ���Թ��У���������ϡ���ᣬ����ɫ����ζ�Ŀ�ȼ���������ɣ����Ʒ�к���Al���� �������һ��NaOH����Һʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ���Ӳ���ɫ
2AlN ȡD��������Ʒ���Թ��У���������ϡ���ᣬ����ɫ����ζ�Ŀ�ȼ���������ɣ����Ʒ�к���Al���� �������һ��NaOH����Һʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ���Ӳ���ɫ ![]()
��������������������������۷�Ӧ�Ʊ�AlN ��ʵ��ʱ���Կ���Ϊԭ���Ʊ�����������ͨ������������Һ��������̼��ͨ��Ũ������ͨ����ԭ�����۳����������������۷�Ӧ���ɵ�������Ϊ��ֹ����������ˮ�⣬�Ʊ�װ�ú�С���ü�ʯ�ҽ��и����2����������װ����Ҫ��©����3���Լ�X��Ũ���ᣬ����Ϊ�����������4��װ��D�е��������۷�Ӧ���ɵ���������5��Al���������ᷴӦ�������������������ᷴӦ����������������6�������ɵ�����ȫ����������V1mLc1mol��L��1�Ĺ����������գ���Һ�����ԣ������̪��ָʾ������Һ����ɫ����c2mol��L��1��NaOH����Һ�ζ����������ᣬ�ﵽ�ζ��յ�ʱ�ʼ��ԣ���Һ�Էۺ�ɫ���ڵ�����������������Һ��Ӧ���ɰ�������Ӧ�ų��İ�����c2mol��L��1 V2mL��NaOH������V1mL c1mol��L��1�����ᣬ���ݹ�ϵʽ���㣻
�������������Ϸ�����1��ʵ��ʱ���������������ҵķ�������װ�õ���ȷ����˳��Ϊj��f e d c a b����b a��g h����h g����i����2������װ���У���Ҫ��©������Ϊ��Һ©������3���Լ�X��Ũ���ᣬ����Ϊ���տ����е�ˮ�������������뻹ԭ���۷�Ӧ����ʵ�飻��4��װ��D�з�Ӧ�Ļ�ѧ����ʽΪ2Al��N2![]() 2AlN����ȡD��������Ʒ���Թ��У���������ϡ���ᣬ����ɫ����ζ�Ŀ�ȼ�������������ɣ����Ʒ�к���Al���ʣ���6����ԭ��Һ�����ԣ����������Ƶĵ��룬��Һ��PH������Һ��Ϊ���ԣ����Ե������һ��NaOH����Һʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ���Ӳ���ɫ�ﵽ�ζ��յ㣻
2AlN����ȡD��������Ʒ���Թ��У���������ϡ���ᣬ����ɫ����ζ�Ŀ�ȼ�������������ɣ����Ʒ�к���Al���ʣ���6����ԭ��Һ�����ԣ����������Ƶĵ��룬��Һ��PH������Һ��Ϊ���ԣ����Ե������һ��NaOH����Һʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ���Ӳ���ɫ�ﵽ�ζ��յ㣻
�� �赪����������Ϊx g
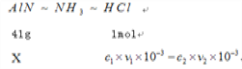
![]()
X=![]() ����Ʒ��A1N����������Ϊ
����Ʒ��A1N����������Ϊ![]()


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ��㶨���ܱ������У����淴ӦA(s)+2B(g) ![]() C(g)+D(g)�ﵽ��ѧƽ��״̬������˵������ȷ������ ��
C(g)+D(g)�ﵽ��ѧƽ��״̬������˵������ȷ������ ��
A��v (B)��=2 v (C)�� B��������ÿ����1 molD��ͬʱ����1molD
C��������������ܶȲ��� D���������м�������A��ƽ�������ƶ���K����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��NH3��H2O�ĵ���ƽ�ⳣ��Kb��1.75��10��5�����¶��£���0.01mol��L��1����ζ�10mLamol��L��1��ˮ����������V��HCl������Һ��pH��ϵ��ͼ��ʾ������˵����ȷ����
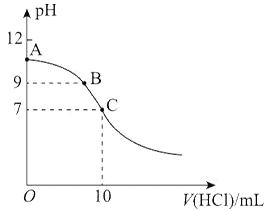
A. A����Һ�м�����ˮ��![]() ��С
��С
B. ԭ��ˮ�����ʵ���Ũ��ԼΪ1.006��10��2mol��L��1
C. A��B��C������Һ��ˮ���������c��OH������A��B��C
D. C��ʱ������Ͱ�ˮǡ����ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ����Һ�У���������һ���ܹ�����ǣ� ��
A.H+ Cu2+ Cl�� SO42��
B.HCO3�� NO3�� Na+ H+
C.SO42�� Cl��Na+ K+
D.Na+SO42��H+ AlO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع�������У���ȷ���ǣ� ��
A.���ǹ��ɿ������ʯ����ҪԪ�أ����ڵؿ��еĺ���������Ԫ���оӵ�һλ
B.��Ļ�ѧ���ʲ����ã��ڳ����²����κ����ʷ�Ӧ
C.���ڵ��ӹ�ҵ��������Ҫ�İ뵼�����
D.������ʺ��ȶ������Ե��ʵ���ʽ��������Ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y��Z����Ԫ�صĵ����ǿ�������Ҫ�ɷ֣�Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ����

A. Y��Z��W����ͬһ����
B. X��Y��Z��W��ԭ����������
C. X��W���γɻ�ѧʽΪXW�����ӻ�����
D. �����Ӱ뾶��ZС��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ˮ���Ӽ�������������ˮ���ӱȽ��ȶ�
B. H2SO4����ˮ�ܵ����H+��SO42-���������������ӻ�����
C. I2��������������ֻ��˷����Ӽ�������
D. SiO2�ۻ��ƻ����ۼ��ͷ��Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У��ڸ����������ܹ������������
A. ͨ������SO2��������Һ�У�H+��Ca2+��Fe3+��NO3-
B. ��ɫ��Һ�У�Al3+��NH4+��Cl-��S2-
C. ʹ��̪���ɫ����Һ:Na+��Cu2+��HCO3-��NO3-
D. c(H+)/c(OH��)=1012����Һ�У�NH4+��Al3+��NO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ڱ��е�λ��ȡ���ڣ� ��
A.Ԫ��ԭ�Ӻ��ڵ�������
B.Ԫ�ص���������ϼ�
C.Ԫ��ԭ�ӵĵ��Ӳ���
D.Ԫ��ԭ�Ӻ���ĵ��Ӳ�����������ϵĵ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com