
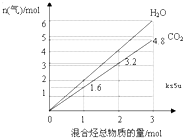
 两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则
两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则| 组合编号 | A的分子式 | B的分子式 | A和B的物质的量比 |
| ① | CH4 | C2H4 | 2:3 |
| ② | CH4 | C3H4 | 7:3 |
| ③ | CH4 | C4H4 | 4:1 |
| ④ | |||
| ⑤ |
| x+2y |
| x+y |
| x+3y |
| x+y |
| x+4y |
| x+y |
| 组合编号 | A的分子式 | B的分子式 | A和B的物质的量比 |
| ① | CH4 | C2H4 | 2:3 |
| ② | CH4 | C3H4 | 7:3 |
| ③ | CH4 | C4H4 | 4:1 |
| ④ | |||
| ⑤ |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
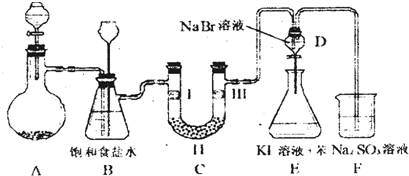
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
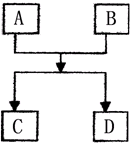 已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.
已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:
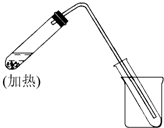 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com