
【题目】NA表示阿伏加罗常数的值,下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA
【答案】B
【解析】解:A、2.4g镁的物质的量为 ![]() =0.1mol,反应中失去0.2mol电子,故A错误;
=0.1mol,反应中失去0.2mol电子,故A错误;
B、标准状况下5.6L二氧化碳的物质的量为 ![]() =0.25mol,含有的氧原子为0.25mol×2=0.5mol,含有的氧原子数为0.5NA , 故B正确;
=0.25mol,含有的氧原子为0.25mol×2=0.5mol,含有的氧原子数为0.5NA , 故B正确;
C、个甲醇含有1个C﹣O键,1个O﹣H,3个C﹣H键,共含有5个σ键,氢原子数为0.4NA的甲醇分子为0.1mol,含有0.5molσ键,故C错误;
D、醋酸是弱酸,不能完全电离,0.1L0.5mol/L CH3COOH溶液中含有的H+数小于0.05NA , 故D错误;
故选:B.
A.镁失去电子生成二价镁离子;
B.将标况下气体的体积转化为物质的量,结合1个二氧化碳分子含有2个氧原子解答;
C.1个甲醇含有1个C﹣O键,1个O﹣H,3个C﹣H键;
D.醋酸是弱酸,不能完全电离.


科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ![]() H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
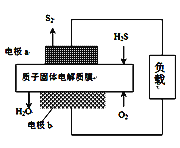
A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e![]() +4 H+=2H2O
+4 H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-![]() H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A. 在Na2B溶液中一定有:c(OH![]() )=c(H
)=c(H![]() )+c(HB
)+c(HB![]() )+2c(H2B)
)+2c(H2B)
B. NaHB溶液可能存在以下关系:c(Na![]() )>c(HB
)>c(HB![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() )
)
C. NaHB水溶液中一定有:c(Na![]() )+c(H
)+c(H![]() )=c(HB
)=c(HB![]() )+c(OH
)+c(OH![]() )+c(B
)+c(B![]() )
)
D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案:
(1)方案一:以铜和浓硫酸反应制备硫酸铜溶液.方案二:将废铜屑在空气中灼烧后再投入稀硫酸.和方案一相比,方案二的优点是;
(2)方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为 .
(3)方案三的实验流程如图1所示:溶解过程中有气体放出,该气体是 . 随着反应的进行,生成气体速度加快,推测可能的原因 . 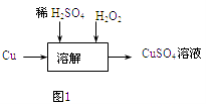
(4)设计实验证明你的推测 .
(5)方案四的实验流程如图2所示:为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为 . 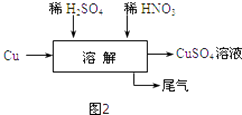
(6)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现代以石油化工为基础的三大合成材料除塑料外,还有_________、_________
Ⅱ.了解一些用药常识,有利于自我保健。
(1)药品常用淀粉作黏合剂,淀粉水解的最终产物是_______________。
(2)现有下列药物:青霉素、阿司匹林、麻黄碱、抗酸药(有效成分为碳酸镁)。
①其中属于解热镇痛药物的是___________,青霉素的作用___________。
②碳酸镁可治疗胃酸过多的原理是(用离子方程式表示)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( ) 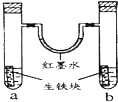
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中负极电极反应相同
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 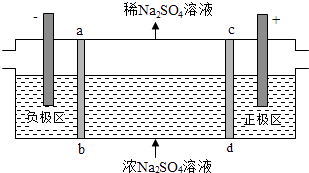
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白酶的叙述,不正确的是( )
A. 蛋白酶是蛋白质
B. 蛋白酶的最适pH值是1.9
C. 蛋白酶只能水解蛋白质
D. 蛋白酶在100℃时完全失活
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com