
����Ŀ��ij������ȤС��̽�����÷�ͭм��ȡCuSO4��Һ����������¼���ʵ�鷽����
��1������һ����ͭ��Ũ���ᷴӦ�Ʊ�����ͭ��Һ��������������ͭм�ڿ��������պ���Ͷ��ϡ���ᣮ�ͷ���һ��ȣ����������ŵ�����
��2����������ʵ���У����������ײ����������Ϻ�ɫ���壬�ټ���ϡ������Ȼ���ܽ⣬�ù���Ϊ ��
��3����������ʵ��������ͼ1��ʾ���ܽ������������ų����������� �� ���ŷ�Ӧ�Ľ��У����������ٶȼӿ죬�Ʋ���ܵ�ԭ�� �� 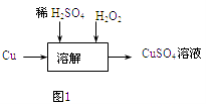
��4�����ʵ��֤������Ʋ� ��
��5�������ĵ�ʵ��������ͼ2��ʾ��Ϊ�˵õ��ϴ���������ͭ��Һ���������������ʵ���֮��ӦΪ �� 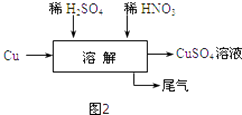
��6���Է����Ľ��в������ƣ����һ�����ܷ�ֹ��Ⱦ������ʵ������ѭ����ʵ�鷽����������ͼ��ʾ����
���𰸡�
��1����������Ⱦ������SO2���壬��ȡ������CuSO4��Һ�����ĵ���������
��2��Cu
��3��O2����Ӧ������Cu2+��H2O2�ֽ��д�����
��4��ȡH2O2��Һ�������еμ�CuSO4��Һ���۲�������ݵ������Ƿ�ӿ�
��5��3��2
��6��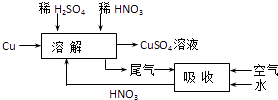
���������⣺��1������2������һ����һ�������зų����ж���������������ɶԿ�������Ⱦ���ڶ�������ͭ������������������ͭ������ͭ�����ᷴӦ��������ͭ��ˮ����˷�Ӧ������û����Ⱦ���ԭ�ϵ������ʸߣ���������ʵ���У����������ײ����������Ϻ�ɫ���壬Ϊͭ��������ϡ������Դ��ǣ���������Ⱦ������SO2���壬��ȡ������CuSO4��Һ�����ĵ��������٣�Cu��
��3.����������ʵ��������ͼ1�У�˫��ˮ��Ӧ������ԭ��Ӧ����O2�����ŷ�Ӧ�Ľ��У����������ٶȼӿ죬�����Ƿ�Ӧ������Cu2+��H2O2�ֽ��д����ã����Դ��ǣ�O2����Ӧ������Cu2+��H2O2�ֽ��д����ã�
��4.��ȡH2O2��Һ�������еμ�CuSO4��Һ������������ݵ����ʼӿ죬��֤��Cu2+��H2O2�ֽ��д����ã�����Cu2+��H2O2�ֽ�û�д����ã����Դ��ǣ�ȡH2O2��Һ�������еμ�CuSO4��Һ���۲�������ݵ������Ƿ�ӿ죻
��5.���������ӷ���ʽ��3Cu+2NO3��+8H+=3Cu2++2NO��+4H2O����Ӧ����2mol���ᣬ����3mol����ͭ����Ϊ�˵õ��ϴ���������ͭ��Һ���������������ʵ���֮��ӦΪ3��2�����Դ��ǣ�3��2��
��6.�����ʵ�鷽��ʱ��Ϊ��ֹNO��Ⱦ������Ӧͨ���������NOΪNO2 �� ��ˮ���պ�����HNO3��ѭ�����á�
���Դ��ǣ�  ��
��


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Fe3����SO42����Al3����M�������������ʵ���֮��2��4��1��1������ͬһ��Һ�У���ôM������(����)
A. Na�� B. OH�� C. Cl�� D. CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пƬ�ʹ�ͭƬ����ͬŨ�ȵ�ϡ������һ��ʱ�䣬����������ȷ����
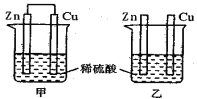
A. ����ͭƬ������������ͭƬ�Ǹ���
B. ����ͭ������������п������
C. �������ݵ����ʼױ��ҿ�
D. ���ձ���ͭƬ����������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH��Һ�ζ�����ʵ���У������õ����ǣ�������
A.��̪
B.Բ���ձ�
C.��ƿ
D.��ʽ�ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�ú������Ҫ�ɷ�ΪAl2O3��SiO2��������������FeO��Fe2O3����Ϊԭ���Ʊ�Al2O3������������
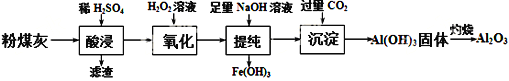
��1�� �������ʱ����������ϡ���ᣬд��Al2O3�ܽ�����ӷ���ʽ___________________��
��2��֤���������Һ�д���Fe3+�ķ����ǣ�ȡ��������Һ���������Թ��У������еμ����軯����Һ����Һ��ΪѪ��ɫ�����������������H2O2��Һ����Һ�ĺ�ɫ�ȱ��֮���ɫ����ȥ�������μӻ��������ݳ����������ʹ�����ǵ�ľ����ȼ��
�ٺ�ɫ�����ԭ���ǣ������ӷ���ʽ��ʾ����_____________________________��
����Һ��ɫ��ȥ�����ڹ���������������������ӣ���֪˫��ˮ����SCN������N2��CO2��SO42-��д���÷�Ӧ�����ӷ���ʽ��____________________________��
���������ݳ���˵��Fe3+��H2O2�ķֽ��д����ã�д�������̵�һ����Ӧ�����ӷ���ʽ________________________________��

��3�� ���ᴿ�������У�������NaOH��Һ�ﵽ���������ʱ����Һ��c(SO42��)��c(Na��)��___________����H2S�Ϳ����Ļ������ͨ��FeCl3 ��FeCl2 ��CuCl2�Ļ����Һ�з�Ӧ����S��������ת����ͼ��ʾ����Ӧ�е���1molH2Sת��Ϊ����ʱ��������Һ��Fe3�������ʵ������䣬��Ҫ����O2�����ʵ���Ϊ______________��
��4�� �������������У�ͨ�����CO2ʱ������Ӧ�Ļ�ѧ����ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ������������ֵ������˵����ȷ���ǣ� ��
A.2.4g Mg������O2��ȼ�գ�ת�Ƶĵ�����Ϊ0.1NA
B.��״���£�5.6L CO2�����к��е���ԭ����Ϊ0.5NA
C.��ԭ����Ϊ0.4NA��CH3OH�����к��еĦҼ���Ϊ0.4NA
D.0.1L0.5mol/L CH3COOH��Һ�к��е�H+��Ϊ0.05NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼ�����Һ�У��ܴ����������������( )
A. K����HCO3����K����SO42�� B. Ba2����NO3����Cl����Na��
C. Na����Cu2����SO42����Cl�� D. Ca2����K����CO32����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У����ڶ����ڵ�����Ԫ���У� ��
A.18��B.15��C.10��D.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ��㶨���ܱ������н��з�ӦA(s)��2B(g)![]() C(g)��D(g)�����������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����( )
C(g)��D(g)�����������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����( )
�����������ܶȲ���
�������������ѹǿ����
���������������ʵ�������
��B�����ʵ���Ũ�Ȳ���
��v��(C)��v��(D)
��v��(B)��2v��(C)
A. �٢ܢݢ� B. �ڢۢ� C. �ڢܢݢ� D. ֻ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com