Ⅰ现有A、B、C三种烃,其球棍模型如图:
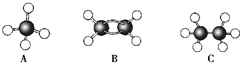
(1)等质量的以上物质完全燃烧时耗去O
2的量最多的是
CH4
CH4
(填分子式,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O
2的量最多的是
C2H6
C2H6
;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是
C2H4
C2H4
,生成水最多的是
CH4
CH4
.
(4)在120℃、1.01×10
5 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是
CH4、C2H4
CH4、C2H4
.
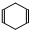
Ⅱ已知

可简写为
.现有某化合物W的分子结构可表示为:
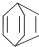
.
(1)W的分子式为
C8H8
C8H8
;W中所有的碳原子
不可能
不可能
(填“可能”或“不可能”)位于同一平面上,W的一氯代物有
2
2
种.
(2)下列有关W的说法不正确的是
b
b
(填编号);
a.能发生氧化反应 b.能发生加聚反应
c.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(3)写出W的芳香族同分异构体(能发生聚合反应)的结构简式
,该聚合反应的化学方程式为
n
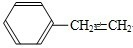
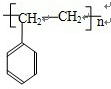
n


.
(4)W属于
bc
bc
(填编号).
a.芳香烃 b.环烃 c.不饱和烃 d.炔烃
(5)W与等物质的量的氢气发生加成反应,生成的有机物
不符合
不符合
(填“符合”或“不符合”)苯的同系物的通式
CnH2n-6
CnH2n-6
(用n表示碳原子个数,写出苯的同系物的通式),写出该物质属于苯的同系物的所有同分异构体:
.


 可简写为
可简写为 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: .
.









 相同但是结构不同;
相同但是结构不同; 相同但是结构不同,所以W的芳香族同分异构体(能发生聚合反应)的结构简式为
相同但是结构不同,所以W的芳香族同分异构体(能发生聚合反应)的结构简式为 ,发生加聚反应的化学方程式为:n
,发生加聚反应的化学方程式为:n
 ;故答案为:
;故答案为: ;n
;n
 ;
; ;
;
 ,故答案为:不符合;CnH2n-6;
,故答案为:不符合;CnH2n-6;
 .
.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 现有A、B、C三种烃,其球棍模型下图:
现有A、B、C三种烃,其球棍模型下图: 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: 钠与水反应的过程如图所示.请回答:
钠与水反应的过程如图所示.请回答: