
| A. |  除去S02中的少量HC1,可将混合气体通人饱和Na2S03溶液 除去S02中的少量HC1,可将混合气体通人饱和Na2S03溶液 | |
| B. |  粘在试管内壁的硫单质,可用热的稀盐酸洗涤 粘在试管内壁的硫单质,可用热的稀盐酸洗涤 | |
| C. |  稀盐酸、NaOH、AICl3、Ba(OH)2四瓶无色溶液,可用NaHC03溶液鉴别 稀盐酸、NaOH、AICl3、Ba(OH)2四瓶无色溶液,可用NaHC03溶液鉴别 | |
| D. |  将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
分析 A.二氧化硫能与饱和Na2S03溶液反应生成亚硫酸氢钠;
B.硫与盐酸不反应;
C.NaHCO3 溶液分别与稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液混合的现象为:气体生成、无现象、气体和沉淀生成、沉淀生成;
D.水温下降,可能为溶解时吸热.
解答 解:A.二氧化硫能与饱和Na2S03溶液反应生成亚硫酸氢钠,将原物质除掉,故A错误;
B.硫与盐酸不反应,应用二硫化碳洗涤,故B错误;
C.NaHCO3 溶液分别与稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液混合的现象为:气体生成、无现象、气体和沉淀生成、沉淀生成,现象不同,可鉴别,故C正确;
D.水温下降,可能为溶解时吸热,则不能说明硝酸铵水解是吸热的,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的鉴别、仪器的洗涤、混合物分离提纯、反应中的热效应及盐类水解等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
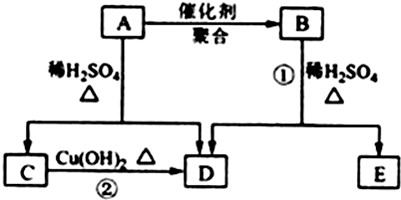
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
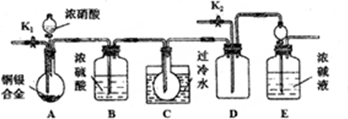
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
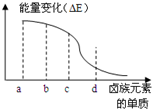 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入稀硝酸无明显现象,再加盐酸溶液产生沉淀,一定有Ag+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氯水,再加KSCN溶液显红色,一定有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com