
【题目】室温下,在20 mL新制氯水中滴加pH=13的NaOH溶液,溶液中水电离的c(H)与 NaOH溶液体积的关系如图所示。已知:K(HClO)=3×108,H2CO3:Ka1=4.3×107,Ka2=5.6×1011。下列说法正确的是
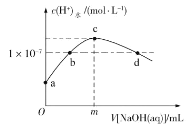
A.m一定等于20
B.b、d点对应的溶液显中性
C.c点溶液中c(Na)=2c(ClO)+2c(HClO)
D.向c点溶液中通入少量CO2:2ClO+H2O+CO2=2HClO+CO32
【答案】C
【解析】
分析题中由水电离的氢离子浓度变化曲线图可知,a~c段水电离出的氢离子浓度逐渐增大,说明这个过程中促进了水的电离,在c~d段水电离出的氢离子浓度逐渐减小,说明此过程中水的电离被抑制。在c点水的电离程度最大,此时溶液中的溶质为:NaCl和NaClO。据此进行判断。
A.NaOH溶液的pH=13,则c(NaOH)=0.1mol·L1,新制氯水的浓度不确定,m不一定等于20,A项错误;
B.由题给信息可知,a点时还未加入NaOH,此时溶液呈酸性,c点中水电离程度最大,此时所得溶液溶质是NaCl和NaClO,溶液呈碱性,故b点溶液呈中性,c~d段水电离出的氢离子浓度逐渐减小,说明随着NaOH的继续加入,水的电离受到抑制,故d点溶液应呈碱性,B项错误;
C.a~c点发生反应为Cl2+2NaOH=NaCl+NaClO+H2O,c(Cl)=c(HClO)+c(ClO),由物料守恒知,c(Na)=c(Cl)+c(HClO)+c(ClO),故c(Na)=2c(ClO)+2c(HClO),C项正确;
D.由电离常数知,电离质子能力:H2CO3>HClO>HCO3-,故H2O+ClO-+CO2= HCO3-+HClO,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,反应过程中-1gc(Ag+)或-1gc[Ag(NH3)2+]与加入氨水体积的关系如图。下列说法错误的是( )
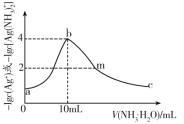
A.原硝酸银溶液的浓度是0.1mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-8
C.溶液b点NH4+的浓度小于溶液c点NH4+的浓度
D.溶液m点c(NO3-)>c(Ag+)+c[Ag(NH3)2+]+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中是否含有某种离子,下列操作方法正确的是()
A.向某溶液中加稀BaCl2,产生白色沉淀,再加入HCl溶液,沉淀不溶解,证明有SO![]()
B.向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO![]()
C.向某溶液中先加入Ba(NO3)2溶液无明显现象,再加入硝酸酸化的AgNO3溶液产生白色沉淀,证明有Cl-
D.向某溶液中加入浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
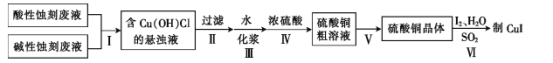
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.8g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A.8.71gB.8.455g
C.8.51gD.7.04g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:
下列说法错误的是
A.原子半径:Y>Z>XB.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态D.Y3Z4是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线图2。下列说法正确的是
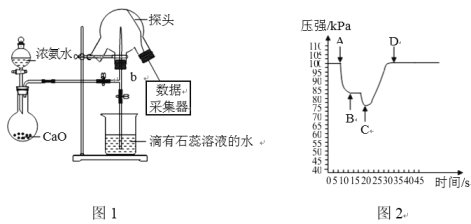
A.干燥氨气通常可选用浓硫酸B.三颈烧瓶内可以看到红色喷泉
C.由图2可知C点时喷泉最剧烈D.图1中氧化钙可用氯化钙代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
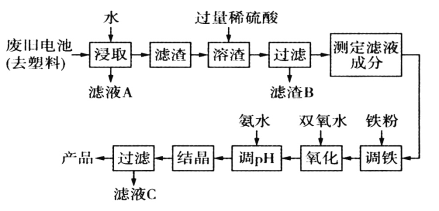
(1)滤液A中溶质的电子式为____________。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_____________________________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:_________________,___________________。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________。
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com