
【题目】已知:一定条件下。向A、B两个恒容密闭容器中分别加入等量的X,发生反应2X(g)![]() 2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )
2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )

A. 若A、B容积相同,但反应温度不同,且温度:A>B
B. 若A、B反应温度相同,但容积不同,且容积:A<B
C. a,c两点对应的平均相对分子质量:a>c
D. t1t2时间段内,A、B两容器中平均反应速率相等
【答案】D
【解析】
A.向A、B两个恒容密闭容器中分别加入等量的X,根据图像,A建立平衡需要的时间短,反应速率快,若A、B容积相同,但反应温度不同,则温度:A>B;正确;
B. 向A、B两个恒容密闭容器中分别加入等量的X,根据图像,A建立平衡需要的时间短,反应速率快,若A、B反应温度相同,但容积不同,则容积:A<B,正确;
C.向A、B两个恒容密闭容器中分别加入等量的X,发生分解反应,该反应为气体体积增大的反应,a,c两点对应X的分解量为c>a,气体的总的物质的量为c>a,气体的质量不变,对应的平均相对分子质量:a>c,正确;
D.根据图像,t1t2时间段内,A中反应处于平衡状态,X的浓度变化值为0,反应的平均反应速率为0,而B中反应正在进行,平均反应速率≠0,错误;
综上所述,本题正确答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知有机物A的分子式为C5H11Br,且不能发生消去反应,则A的结构简式为_______;
(2)已知有机物A的分子式为C7H8O2,有机物A的结构有多种:若A可与FeCl3溶液发生显色反应,且1 mol的A可与2 mol的Na2CO3反应,则A共有______种,其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构有两种,它们的结构简式分别为___________、____________。
(3)已知烯烃能被酸性KMnO4溶液氧化,![]()
1mol的某烃A完全燃烧生成5molCO2和4molH2O,则A的分子式为_____,若该烃用酸性KMnO4溶液氧化后得到HOOCCH2CH2CH2COOH,由此推断该烃的结构的结构简式:__________;若A的一氯代物只有一种,则A的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是( )
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O 4e– = O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.晶体硅可制作太阳能电池的芯片B.稀硝酸可以用铝槽来运输
C.氧化铁可用来制作红色油漆和涂料D.用镁铝合金可作飞机制造材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学工艺流程不可行的是
A. 实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B. 石英砂![]() 粗硅
粗硅![]() 粗SiCl4
粗SiCl4![]() 高纯硅
高纯硅
C. FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D. 1mol 苯中含有碳碳双键的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
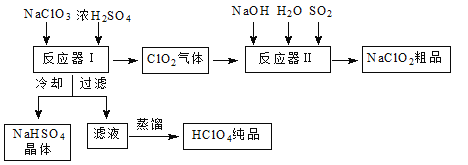
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是_________________________。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有________________,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,在400℃时开始分解,产物为N2、Cl2、O2、H2O,用以下装置进行NH4ClO4分解实验。下列有关叙述正确的是

A. 高氯酸铵分解产生的Cl2、N2、O2都可用排空气法收集
B. 可按①③②④的连接顺序制得干燥纯净的N2
C. 1mol NH4ClO4分解,标准状况下收集到气体体积为44.8L
D. 装置①也可用于实验室加热NH4Cl或NH4NO3制备NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com