
【题目】用NaOH固体配制250 mL 1.00 mol/L NaOH溶液时,不必用到的仪器是
A.试管B.玻璃棒C.胶头滴管D.容量瓶
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是
A. 试管内壁附着的硫可用二硫化碳溶解除去
B. 游离态的硫存在于火山喷口附近或地壳的岩层里
C. 单质硫既有氧化性,又有还原性
D. 硫在过量纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1 molH2的质量是1 g
B.1 mol HCl的质量是36.5 gmol﹣1
C.Cl2的摩尔质量等于它的相对分子质量
D.硫酸根离子的摩尔质量是96 gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
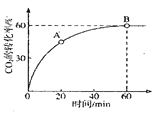
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
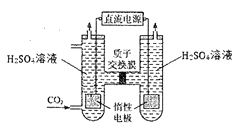
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(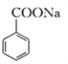 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.灼热的炭与CO2反应B.甲烷与O2的燃烧反应
C.铝与稀盐酸D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com