
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】25℃时,相同的镁条与下列酸溶液反应,反应开始时放出H2最快的是( )
A.10mL 1mol/L 硫酸B.10mL 1mol/L 醋酸
C.10mL 3mol/L 硝酸D.40mL 1mol/L 盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热条件下,一定能说明反应A(g)+B(?)![]() 2C(g)已达到平衡状态的是
2C(g)已达到平衡状态的是
A. 容器内的密度不再变化 B. C的生成速率与A的分解速率之比为2:1
C. 混合物的平均摩尔质量不再变化 D. 容器内的温度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有各组物质:①O2和O3 ②![]() 和
和![]() ③
③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤  ⑥
⑥ ![]() 和质量数为238、中子数为146的原子 ⑦
和质量数为238、中子数为146的原子 ⑦![]()
请按要求用序号填空:
(1)属于同系物的是___________(2)属于同分异构体是_________(3)属于同位素的是_________(4)属于同素异形体的是________(5)属于同种物质的是___________
II.命名或写出结构简式:
(1)  ________________________________
________________________________
(2)2-乙基-1-戊烯 _______________________________
(3)支链上只有一个乙基,且式量最小的烷烃 _________________
【答案】 ④ ⑦ ⑥ ① ⑤ 3,4﹣二甲基﹣4﹣乙基庚烷 CH2=C(CH2CH3)CH2CH2CH3 
【解析】Ⅰ、同系物是指结构相似,组成上相差1个或者若干个CH2原子团的化合物。具有相同分子式而结构不同的化合物互为同分异构体;质子数相同质量数(或中子数)不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;
①O2和O3是由氧元素组成的不同单质,互为同素异形体;②CH2=CH-CH3和CH2=CH-CH=CH2的结构不同,分子式也不同;③![]() 和
和![]() 分子式不同,结构也不同;④
分子式不同,结构也不同;④![]() 和
和![]() 的结构相似,组成上相差2个CH2,属于同系物;⑤
的结构相似,组成上相差2个CH2,属于同系物;⑤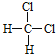 和
和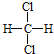 组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与
组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与![]() 的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
故答案为:(1)④;(2)⑦;(3)⑥;(4)①;(5)⑤。
II、(1)烷烃命名时,选最长碳链为主链,从支链最近的一端进行编号;该物质最长碳链含有七个碳,2个-CH3分别在3、4号位,1个乙基在4号位,故命名为:3,4﹣二甲基﹣4﹣乙基庚烷;
(2)2-乙基-1-戊烯,含碳碳双键在内最长碳链有5个碳原子,离双键最近的一端编号,碳碳双键在1号碳,2号碳有一个乙基,据此写出结构简式:CH2=C(CH2CH3)CH2CH2CH3;
(3)支链的长度不能超过其所在位置两侧的主链的长度,烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为 。
。
【题型】综合题
【结束】
24
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的标志,乙烯有如下转化关系。
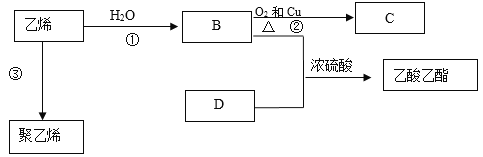
请回答下列问题:
(1)乙烯的结构简式为______。
(2)B所含官能团的名称为____________。
(3)③的反应类型是____________。
(4)浓硫酸的作用是________________。
(5)反应①的化学方程式为________________________________________________。
反应②的化学方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
(1)①某温度下,若把 10 mol N2 与 30 mol H2置于体积为 10 L 的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为 20%,则该温度下反应的K=_______ (可用分数表示)。
②对于合成氨反应而言,下列有关图像一定正确的是______(选填序号)。
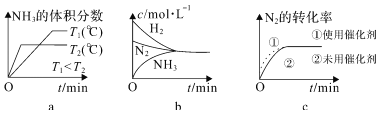
③在碱性溶液中通过电解法可以实现由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,阴极的电极反应式是_______________。
4NH3+3O2,阴极的电极反应式是_______________。
(2)室温下,若将 0.1 mol·L-1 盐酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 随加入盐酸体积的变化曲线如下图所示。
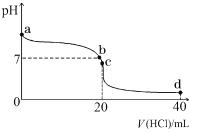
①NH3·H2O 的电离方程式是_______________。
②b 点所示溶液中的溶质是_______________。
③c 点所示溶液中,离子浓度从大到小的关系为_______________。
④常温下,若将 amol/LNH3·H2O 与等体积的 bmol/L 的盐酸混合,充分反应后溶液呈中性(不考虑氨水和盐酸的挥发),则该温度下 NH3·H2O 的电离常数Ka=___________(用含 a 和 b 的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断正确的是
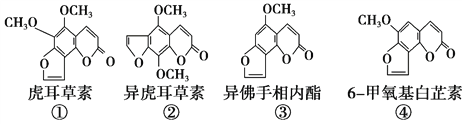
A. ①、②、③、④互为同分异构体
B. ①、③互为同系物
C. 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少
D. ①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com