
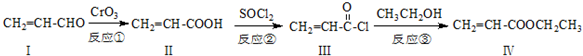
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 反应的产物.
反应的产物.| 点燃 |
| Cu |
| △ |
| Cu |
| △ |
 反应的产物为:
反应的产物为: .
. .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
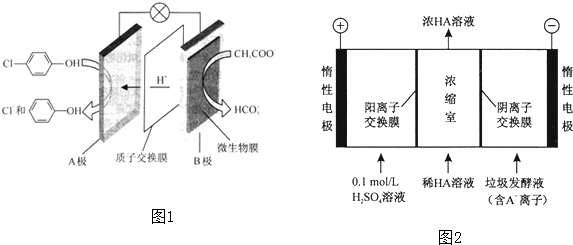
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
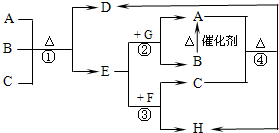 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B |
| ① | 用滴管从试剂瓶中吸取液体 | |
| ② | 让往玻璃导管套上橡皮管容易些 | |
| ③ | 为使加热的蒸发皿里的液体不溅出 | |
| ④ | 往大试管里加入颗粒状锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+C02↑ |
| B、Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
| C、硫酸工业尾气中的SO2用过量的氨水吸收:2NH3?H2O+SO2=2NH4++SO32-+H2O |
| D、Cu溶于浓HNO3:Cu+4H++2NO3一=Cu2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com