
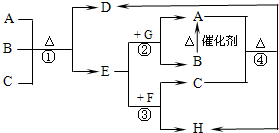
 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.| 5 |
| 3 |
| 5 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
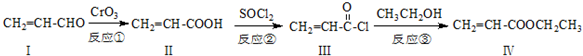
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.
合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.| 7 |
| 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:CO2>KCl>SiO2 |
| B、沸点:HF>HBr>HI |
| C、热稳定性:PH3<H2S<HCl |
| D、硬度:铝>镁>铝镁合金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com