
 合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.
合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.| 7 |
| 8 |
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 7 |
| 8 |
| 7 |
| 8 |
| 0.3-x+0.5-3x+2x |
| 0.3+0.5 |
| 7 |
| 8 |
| 0.15mol |
| 0.5mol |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
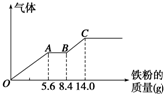 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
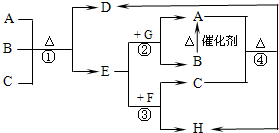 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B |
| ① | 用滴管从试剂瓶中吸取液体 | |
| ② | 让往玻璃导管套上橡皮管容易些 | |
| ③ | 为使加热的蒸发皿里的液体不溅出 | |
| ④ | 往大试管里加入颗粒状锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
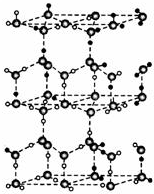 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L该溶液中含有NH4+的物质的量为0.1 mol |
| B、通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| C、c(NH4+)+c(OH-)=c(Cl-)+c(H+) |
| D、c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com