

| M | N | R | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铁 | 铜 | FeCl3溶液 |
| C | 铁 | 银 | 硝酸银 |
| D | 铜 | 铁 | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | (1)(4)(5) | B. | (2)(3)(5) | C. | (1)(3)(4) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素形成的最高价氧化物对应的水化物中,酸性最强的是HClO4 | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 用电子式表示HCl形成过程:H-+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 第VⅡA族元素形成的氢化物中沸点最高的是HI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ①②⑦⑨ | C. | ③⑤⑥⑩ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
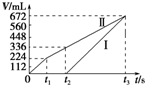 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com