
【题目】关于如右图所示的原电池,下列说法正确的是( )。

A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e-===H2↑
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向正反应方向移动 D.C的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:
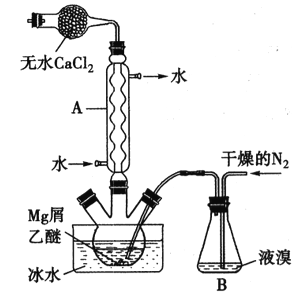
步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
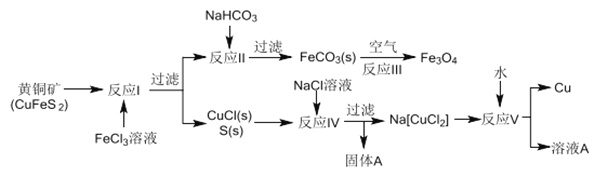
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关SO2的性质,下列说法不正确的是
A. 能使品红溶液褪色 B. 能与NaOH溶液反应
C. 能与H2O反应生成H2SO4 D. 一定条件下能与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是
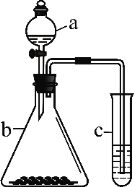
选项 | a | b | c | c试管中现象 |
A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人分析一些小而可溶的有机分子样品时,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是( )
A. 脂肪 B. 氨基酸
C. 葡萄糖 D. 油类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。
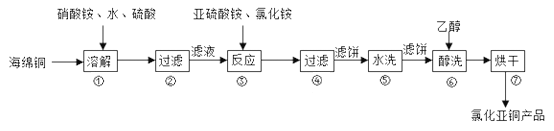
回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比![]() 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
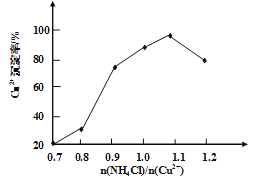
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,②H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是
A. 氢氟酸的电离方程式及热效应可表示为: HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com