
����Ŀ���������һ�����ᣬ��������ʴ������
��֪25��ʱ����HF(aq)+OH-(aq)=F-(aq)+H2O��1����H=-67��7kJ��mol-1����H+(aq)+OH-(aq)=H2O��1�� ��H=-57��3kJ��mol-1����20mL0��1mol��L-1������м���VmL0��1mol��L-1NaOH��Һ�������й�˵������ȷ����
A. �����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ�� HF(aq)![]() F-(aq)+ H+(aq) ��H=-10��4kJ��mol-1
F-(aq)+ H+(aq) ��H=-10��4kJ��mol-1
B. ��V=20ʱ����Һ�У�c(OH-)=c(HF)+c(H+)
C. ��V=20ʱ����Һ�У�c(F-)<c(Na+)=0��1mol��L-1
D. ��V>0ʱ����Һ�п��ܴ��ڣ�c(Na+)>c(F-)>c(OH-)>c(H+)
���𰸡�C
�����������������A�����ݸ�˹���ɣ���-���ɵ������ĵ��뷽��ʽ����ЧӦ���ɱ�ʾΪHF(aq)![]() F-(aq)+ H+(aq) ��H=��-67��7kJ��mol-1��-��-57��3kJ��mol-1��=-10��4kJ��mol-1����ȷ��B����V=20ʱ��HF��NaOHǡ����ȫ��Ӧ����HF�����ᣬ������ҺΪǿ����������Һ����Һ�ʼ��ԣ����������غ㣬��c(OH-)=c(HF)+c(H+)����ȷ��C����V=20ʱ�������ӵ�Ũ�ȱ�Ϊԭ����1/2��������Һ�У�c(F-)<c(Na+)=0��05mol��L-1������D�����ݵ���غ㣬��c(Na+)+ c(H+)=c(F-)+c(OH-)����V>0ʱ�����ܴ���c(Na+)>c(F-)>c(OH-)>c(H+)����ȷ����ѡC��
F-(aq)+ H+(aq) ��H=��-67��7kJ��mol-1��-��-57��3kJ��mol-1��=-10��4kJ��mol-1����ȷ��B����V=20ʱ��HF��NaOHǡ����ȫ��Ӧ����HF�����ᣬ������ҺΪǿ����������Һ����Һ�ʼ��ԣ����������غ㣬��c(OH-)=c(HF)+c(H+)����ȷ��C����V=20ʱ�������ӵ�Ũ�ȱ�Ϊԭ����1/2��������Һ�У�c(F-)<c(Na+)=0��05mol��L-1������D�����ݵ���غ㣬��c(Na+)+ c(H+)=c(F-)+c(OH-)����V>0ʱ�����ܴ���c(Na+)>c(F-)>c(OH-)>c(H+)����ȷ����ѡC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ��ʾ��ԭ��أ�����˵����ȷ����( )��

A��������п�缫ͨ������������ͭ�缫
B��п�缫������ԭ��Ӧ��ͭ�缫����������Ӧ
C������13 g Zn�ܽ�ʱ������·�о���0.4 mol����ͨ��
D��ͭ�缫�������������ĵ缫��ӦΪ2H����2e��===H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʵ�����Ʊ�1��2������������ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ����������CCl4��Һ���������Ҵ��Ʊ�1��2�����������װ������ͼ��ʾ��

�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | һl30 | 9 | ��1l6 |
�ش��������⣺
(1)�Ʊ�1��2����������ĺϳ�·��
(2)��װ��C��Ӧ���� ��(����ȷѡ��ǰ����ĸ)��Ŀ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
(3)װ��B�������� ��
(4)�����������������������ѣ����� �ķ�����ȥ��
(5)��Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���� �����ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �ƺͼصĺϽ�����ڿ����ӷ�Ӧ�����Ƚ�����
B. ���ó���������ĵ���������оƬ
C. �����ö�����̼����ȫ��������
D. �����ж�����������ҩ��ĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.1 mol��L��1�Ĵ�����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
���������ռ���� �������¶� �������������� ����ˮ
A���٢� B���ڢ� C���ۢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ����ܷ�Ӧ�����ӷ���ʽΪ2Fe3��+Fe=3Fe2�������²���ʵ�ָ÷�Ӧ��ԭ�����( )
A������ΪCu������ΪFe���������ҺΪFeCl3
B������ΪC������ΪFe���������ҺΪFe(NO3)3
C������ΪFe������ΪZn���������ҺΪFe2(SO4)3
D������ΪAg������ΪFe���������ҺΪFe2(SO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������A��B����Ӧ��
A: 2NaOH+H2SO4=Na2SO4+2H2O��B:Zn+H2SO4=ZnSO4+H2��
��A��B��Ӧ����Ƴ�Ϊԭ��ص���____(�A����B��)��
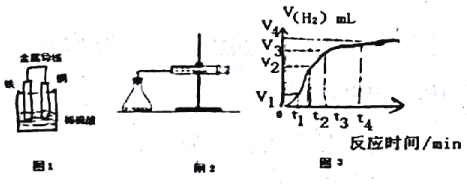
��2��ijԭ���ʾ��ͼ��ͼ1����õ�ظ����缫�ķ�Ӧ����ʽΪ_______________��
��3�����õ�ط�Ӧ�����й���0.3mol���ӷ���ת�ƣ������ɵ���������ڱ�״���µ������_____L��
��4��Ϊ���о�Fe��ϡH2SO4��Ӧ�����ʣ�ijͬѧͨ����ͼ2ʵ��װ�òⶨ��Ӧ�����ɵ�H2�������������ͼ3��ʾ�����ߣ��ڸ�ʵ������з�����ƿ�¶����ߡ���ش��������⡣
��0��tl��tl��t2��t2��t3����ʱ������Ӧ��������ʱ�����____����������������ܵ�ԭ����_____����ʵ��������ռ���������������______ʱ���ڡ�
��5��Ϊ�˼����÷�Ӧ�����ʣ�����Ϊ���еķ�����________��
A����H2SO4��Һ�м�����ˮ B����FeƬ�ij�Fe��
C����H2SO4��Һ�м�Na2SO4��Һ D����H2SO4��Һ�е��뼸��Cu(NO3)2��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ȷ����(����)
A. ͨ�����Ǻ͵��۶����Ի�ԭ��
B. ������ͭ�ο���ʹ�����ʲ�������
C. ��ͨ��������֬�����������Ƶõ�
D. ��ά�ط������������ǵ�Ԫ��ɵ������Ա��ֳ�һЩ��Ԫ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com