
����Ŀ����֪ʵ�����Ʊ�1��2������������ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ����������CCl4��Һ���������Ҵ��Ʊ�1��2�����������װ������ͼ��ʾ��

�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | һl30 | 9 | ��1l6 |
�ش��������⣺
(1)�Ʊ�1��2����������ĺϳ�·��
(2)��װ��C��Ӧ���� ��(����ȷѡ��ǰ����ĸ)��Ŀ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
(3)װ��B�������� ��
(4)�����������������������ѣ����� �ķ�����ȥ��
(5)��Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���� �����ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ���� ��
���𰸡�(1)CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
(2) c ���շ�Ӧ�п������ɵ��������� (3)��ֹ����(4) ����
(5) ��ȴ�ɱ�����Ĵ����ӷ� 1��2������������۵�ͣ�������ȴ�����̶���������
��������
���������(1)ʵ�����Ʊ�1��2-��������ķ�Ӧԭ��Ϊ���ȷ����Ҵ�����ȥ��Ӧ������ϩ���ٷ�����ϩ����ˮ�ļӳɷ�Ӧ���ϳ�·��ΪCH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br[��
BrCH2CH2Br[��
(2)Ũ�������ǿ�����ԣ����Ҵ������ɶ�����̼����������ԭ�ɶ�����������̼�����������ܺ�����������Һ��Ӧ�������գ���װ��C���Լ�ΪNaOH��Һ����Ŀ�������շ�Ӧ�п������ɵ�����������
(3)װ��B�г����ܵ������Ƿ�������
(4)���߾�Ϊ�л�����ܣ���1��2-�������������ѵķе㲻ͬ��������ķ��������Ƿ��룻
(5)���ڳ����£��ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ�����ȴ�ɱ�����Ĵ����ӷ�����1��2-������������̵�9���ϵͣ����ܹ�����ȴ��������ȴ��ʹ�����̶�ʹ��·����������B�г�������Һ��������


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ������ͼ��ʾ���г�������ȥ������Ҫ�������£�
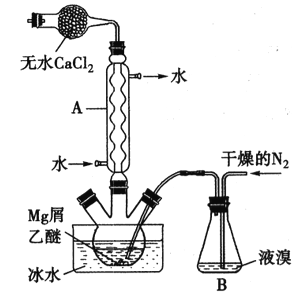
����l������ƿ��װ��10gþм��150mL��ˮ���ѣ�װ��B�м���������Һ�塣
����2������ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3����Ӧ��Ϻ�ָ������£����ˣ�����Һת������һ�������ƿ�У���ȴ��0�棬�������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4���������ñ��ܽ��Ʒ����ȴ��0�棬�������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160��ֽ����ˮMgBr2��Ʒ��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԡ�
��MgBr2+3C2H5OC2H5= MgBr2��3C2H5OC2H5
��ش�
(1)����A��������___________������ʵ���е�������____________��
(2)����2�У����Խ�Bװ���е�����ȫ��������ƿ�е�ԭ����_______����ʵ�����������Һ��һ����ȫ����������ƿ�У�������_____________��
(3)����3�У���һ�ι��˵õ��Ĺ���������______�����ݲ���3��4�����ܽ�������Ѻ��廯þ�����е��������ʣ�_________��
(4)�����Mg���������ʵ��֤��O2�������Ա�N2��ǿ��________��
(5)������õ��IJ�Ʒ�ڸ���������ȴ�����º�����������Ϊ61.4g�����ʵ����ȡMgBr2�IJ�����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����˷���һЩС�����ܵ��л�������Ʒʱ���������Ǻ���̼���⡢��������Ԫ������Щ��Ʒ�ܿ�����(����)
A. ֬�� B. ������
C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl���㷺���ڻ�����ӡȾ���л��ϳɵ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼�������Ȼ���ͭ�Ĺ��չ�������ͼ��ʾ��
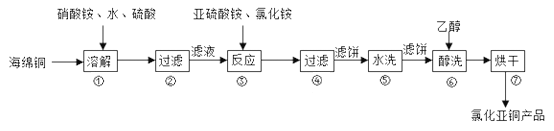
�ش��������⣺
��1��CuCl��CuԪ�������ڱ��е�λ��Ϊ___________��
��2���������NԪ�ر���ԭΪ��ͼۣ���Cu�ܽ�����ӷ���ʽΪ________���ܽ��¶�Ӧ������60~70�棬ԭ����______________��
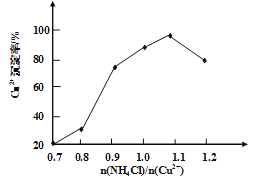
��3��д�����������Ҫ��Ӧ�����ӷ���ʽ________��(NH4)2SO3Ҫ�ʵ�������Ŀ���У���֤Cu2+�Ļ�ԭ���ʣ�__________����֪NH4Cl��Cu2+�����ʵ���֮��![]() ��Cu2+�����ʵĹ�ϵ��ͼ��ʾ�����Ȼ���������ӵ�һ��Ũ�Ⱥ��Ȼ���ͭ�ij����ʼ��٣�ԭ����________��
��Cu2+�����ʵĹ�ϵ��ͼ��ʾ�����Ȼ���������ӵ�һ��Ũ�Ⱥ��Ȼ���ͭ�ij����ʼ��٣�ԭ����________��
��4����������Ҵ�ϴ�ӵ�Ŀ����__________��
��5���Ȼ���ͭ�Ķ���������
�ٳ�ȡ��Ʒ0.250g��10mL������FeCl3��Һ��250mL��ƿ�У�����ܽ⣻
����0.100mol��L��1������[Ce(SO4)2]����Һ�ⶨ����֪��CuCl+FeCl3=CuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+��
����ƽ��ʵ�������±���ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.250g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ_______���������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ�⡰�˹���Ҷ���ĵ绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ�ϣ�C3H8O��������˵���������
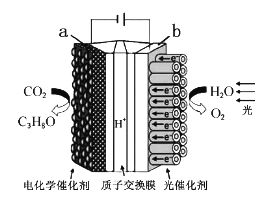
A. ��װ�ù���ʱ��H+��b������a����Ǩ��
B. ÿ����1molO2����44gCO2����ԭ
C. a�缫�ķ�ӦʽΪ3CO2+18H++18e��=C3H8O+5H2O
D. C3H8O��O2�γ�ȼ�ϵ��������������Ϊ�������Һ�ĸ�����Ӧʽ��C3H8O��18e��+24OH��=3CO32��+16H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������ԭ��Ӧ�����ܴ���������ǣ� ��
A.K+��H+��Fe2+��MnO4��
B.Fe3+��Ba2+��SO42����NO3��
C.Al3+��Na+��SO42����CO32��
D.Fe3+��H+��SO42����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(58Ce)����������ϡ�����Բ��ϣ���Ӧ�������첣�������ʯ���մɺͺϽ�ȡ���֪��Ce4++Fe2+=Ce3++Fe3+������˵����ȷ����( )
A. CeԪ��λ��Ԫ�����ڱ��������ڵ�IIIB��
B. ![]() ��
��![]() ��ͬ��������
��ͬ��������
C. ��������HI��Һ��������Ӧ�����ӷ���ʽΪ��Ce+4H+=Ce4++2H2
D. ���ԭ�Ӻ�����58������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ�����ᣬ��������ʴ������
��֪25��ʱ����HF(aq)+OH-(aq)=F-(aq)+H2O��1����H=-67��7kJ��mol-1����H+(aq)+OH-(aq)=H2O��1�� ��H=-57��3kJ��mol-1����20mL0��1mol��L-1������м���VmL0��1mol��L-1NaOH��Һ�������й�˵������ȷ����
A. �����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ�� HF(aq)![]() F-(aq)+ H+(aq) ��H=-10��4kJ��mol-1
F-(aq)+ H+(aq) ��H=-10��4kJ��mol-1
B. ��V=20ʱ����Һ�У�c(OH-)=c(HF)+c(H+)
C. ��V=20ʱ����Һ�У�c(F-)<c(Na+)=0��1mol��L-1
D. ��V>0ʱ����Һ�п��ܴ��ڣ�c(Na+)>c(F-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֲ�ͬ���ʵ���Ũ�ȵ�Na2CO3��Һ�����¶���Һ��c(CO32-)�仯��ͼ��ʾ�������������ʵ���Ũ�ȹ�ϵ��ȷ������ ��
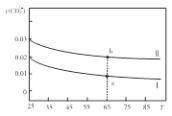
A������ҺI�����¶ȣ���ҺpH��С
B����Һa����Һb��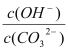 ����
����
C��65��ʱ������Һa�м���1.06gNa2CO3�������ܽ��Ϊ��Һb
D����ҺIIһ��������c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com