
ЁОЬтФПЁПЃЈ1ЃЉЯжгаШчЯТAЁЂBСНЗДгІЃК
A: 2NaOH+H2SO4=Na2SO4+2H2OЃЛB:Zn+H2SO4=ZnSO4+H2Ёќ
дђAЁЂBЗДгІФмЩшМЦГЩЮЊдЕчГиЕФЪЧ____(ЬюЁАAЁБЛђЁАBЁБ)ЁЃ
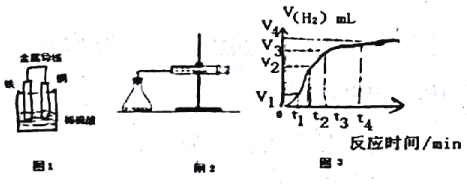
ЃЈ2ЃЉФГдЕчГиЪОвтЭМШчЭМ1ЃЌдђИУЕчГиИКМЋЕчМЋЕФЗДгІЗНГЬЪНЮЊ_______________ЁЃ
ЃЈ3ЃЉШєИУЕчГиЗДгІЙ§ГЬжаЙВга0.3molЕчзгЗЂЩњзЊвЦЃЌдђЩњГЩЕФЦјЬхЬхЛ§дкБъзМзДПіЯТЕФЬхЛ§ЪЧ_____LЁЃ
ЃЈ4ЃЉЮЊСЫбаОПFeгыЯЁH2SO4ЗДгІЕФЫйТЪЃЌФГЭЌбЇЭЈЙ§ШчЭМ2ЪЕбщзАжУВтЖЈЗДгІжаЩњГЩЕФH2ЬхЛ§ЃЌЛцжЦСЫШчЭМ3ЫљЪОЕФЧњЯпЃЌдкИУЪЕбщЙ§ГЬжаЗЂЯжзЖаЮЦПЮТЖШЩ§ИпЁЃЧыЛиД№вдЯТЮЪЬтЁЃ
дк0ЁЋtlЁЂtlЁЋt2ЁЂt2ЁЋt3ИїИіЪБМфЖЮРяЃЌЗДгІЫйТЪзюДѓЕФЪБМфЖЮЪЧ____ЃЌВњЩњетжжЧщПіПЩФмЕФдвђЪЧ_____ЃЛИУЪЕбщЙ§ГЬжаЪеМЏЕНЦјЬхзюЖрЕФЪЧдк______ЪБМфФкЁЃ
ЃЈ5ЃЉЮЊСЫМѕЛКИУЗДгІЕФЫйТЪЃЌФуШЯЮЊПЩааЕФЗНЗЈЪЧ________ЁЃ
AЃЎЯђH2SO4ШмвКжаМгеєСѓЫЎ BЃЎНЋFeЦЌИФГЩFeЗл
CЃЎЯђH2SO4ШмвКжаМгNa2SO4ШмвК DЃЎЯђH2SO4ШмвКжаЕЮШыМИЕЮCu(NO3)2ШмвКЃЎ
ЁОД№АИЁП B Zn ЁЊ2eЁЊ==Zn2+ 3.36 t1ЁЋt2 ИУЗДгІЗХШШЃЌМгПьЛЏбЇЗДгІЪБЫйТЪ t1ЁЋt2 AЁЂC
ЁОНтЮіЁПЃЈ1ЃЉAЪЧжаКЭЗДгІЃЌУЛгаЕчзгзЊвЦЃЌВЛФмЩшМЦЮЊдЕчГиЃЛBЪЧжУЛЛЗДгІЃЌЪєгкбѕЛЏЛЙдЗДгІЃЌПЩвдЩшМЦЮЊдЕчГиЃЛЃЈ2ЃЉаПЕФН№ЪєадЧПгкЭЃЌаПЪЧИКМЋЃЌдђИУЕчГиИКМЋЕчМЋЕФЗДгІЗНГЬЪНЮЊ ZnЃ2eЃЃНZn2+ЁЃЃЈ3ЃЉе§МЋЪЧЧтРызгЗЂЩњЕУЕНЕчзгЕФЛЙдЗДгІЃЌШєИУЕчГиЗДгІЙ§ГЬжаЙВга0.3molЕчзгЗЂЩњзЊвЦЃЌдђЩњГЩЕФЧтЦјЪЧ0.15molЃЌдкБъзМзДПіЯТЕФЬхЛ§ЪЧ0.15molЁС22.4L/molЃН3.36LЁЃЃЈ4ЃЉЧњЯпаБТЪдНДѓЃЌЗДгІЫйТЪдНПьЃЌдђЗДгІЫйТЪзюДѓЕФЪБМфЖЮЪЧt1ЁЋt2ЃЌВњЩњетжжЧщПіПЩФмЕФдвђЪЧИУЗДгІЗХШШЃЌЮТЖШЩ§ИпМгПьЛЏбЇЗДгІЪБЫйТЪЃЛИљОнзнзјБъПЩжЊИУЪЕбщЙ§ГЬжаЪеМЏЕНЦјЬхзюЖрЕФЪЧдкt1ЁЋt2ЪБМфФкЁЃЃЈ5ЃЉAЃЎЯђH2SO4ШмвКжаМгеєСѓЫЎЧтРызгХЈЖШНЕЕЭЃЌЗДгІЫйТЪМѕаЁЃЌAе§ШЗЃЛBЃЎНЋFeЦЌИФГЩFeЗлдіДѓЗДгІЮяНгДЅУцЛ§ЃЌЗДгІЫйТЪМгПьЃЌBДэЮѓЃЛCЃЎЯђH2SO4ШмвКжаМгNa2SO4ШмвКЯрЕБгкЯЁЪЭЃЌЧтРызгХЈЖШМѕаЁЃЌЗДгІЫйТЪМѕаЁЃЌCе§ШЗЃЛDЃЎЯђH2SO4ШмвКжаЕЮШыМИЕЮCu(NO3)2ШмвКЃЌдкЫсадШмвКжаЯѕЫсИљОпгаЧПбѕЛЏадЃЌКЭН№ЪєЗДгІЕУВЛЕНЧтЦјЃЌDДэЮѓЃЌД№АИбЁACЁЃ


 ШЋгХЕуСЗЕЅдЊМЦЛЎЯЕСаД№АИ
ШЋгХЕуСЗЕЅдЊМЦЛЎЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШЛЏбЧЭЃЈCuClЃЉЙуЗКгУгкЛЏЙЄЁЂгЁШОЁЂгаЛњКЯГЩЕШаавЕЁЃCuClФбШмгкДМКЭЫЎЃЌПЩШмгкТШРызгХЈЖШНЯДѓЕФЬхЯЕЃЌдкГБЪЊПеЦјжавзЫЎНтбѕЛЏЁЃвдКЃУрЭЃЈжївЊГЩЗжЪЧCuКЭЩйСПCuOЃЉЮЊдСЯЃЌВЩгУЯѕЫсяЇбѕЛЏЗжНтММЪѕЩњВњТШЛЏбЧЭЕФЙЄвеЙ§ГЬШчЯТЭМЫљЪОЁЃ
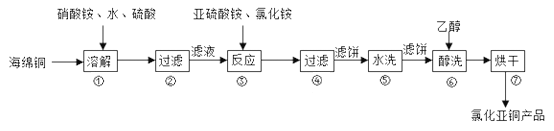
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉCuClжаCuдЊЫидкжмЦкБэжаЕФЮЛжУЮЊ___________ЁЃ
ЃЈ2ЃЉВНжшЂйжаNдЊЫиБЛЛЙдЮЊзюЕЭМлЃЌдђCuШмНтЕФРызгЗНГЬЪНЮЊ________ЁЃШмНтЮТЖШгІПижЦдк60~70ЁцЃЌдвђЪЧ______________ЁЃ
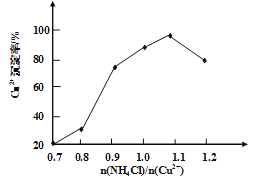
ЃЈ3ЃЉаДГіВНжшЂлжажївЊЗДгІЕФРызгЗНГЬЪН________ЁЃ(NH4)2SO3вЊЪЪЕБЙ§СПЃЌФПЕФгаЃКБЃжЄCu2+ЕФЛЙдЫйТЪЃЌ__________ЁЃвбжЊNH4ClЁЂCu2+ЕФЮяжЪЕФСПжЎБШ![]() гыCu2+ГСЕэТЪЕФЙиЯЕШчЭМЫљЪОЃЌЕБТШЛЏяЇгУСПдіМгЕНвЛЖЈХЈЖШКѓТШЛЏбЧЭЕФГСЕэТЪМѕЩйЃЌдвђЪЧ________ЁЃ
гыCu2+ГСЕэТЪЕФЙиЯЕШчЭМЫљЪОЃЌЕБТШЛЏяЇгУСПдіМгЕНвЛЖЈХЈЖШКѓТШЛЏбЧЭЕФГСЕэТЪМѕЩйЃЌдвђЪЧ________ЁЃ
ЃЈ4ЃЉВНжшЂоМгШыввДМЯДЕгЕФФПЕФЪЧ__________ЁЃ
ЃЈ5ЃЉТШЛЏбЧЭЕФЖЈСПЗжЮіЃК
ЂйГЦШЁбљЦЗ0.250gКЭ10mLЙ§СПЕФFeCl3ШмвКгк250mLзЖаЮЦПжаЃЌГфЗжШмНтЃЛ
ЂкгУ0.100molЁЄLЃ1СђЫсюц[Ce(SO4)2]БъзМШмвКВтЖЈЁЃвбжЊЃКCuCl+FeCl3=CuCl2+FeCl2ЁЂFe2++Ce4+=Fe3++Ce3+ЁЃ
Ш§ДЮЦНКтЪЕбщНсЙћШчЯТБэЃЈЦНКтЪЕбщНсЙћЯрВюВЛФмГЌЙ§1%ЃЉЃК
ЦНКтЪЕбщДЮЪ§ | 1 | 2 | 3 |
0.250gбљЦЗЯћКФСђЫсюцБъзМШмвКЕФЬхЛ§ЃЈmLЃЉ | 24.35 | 24.05 | 23.95 |
дђбљЦЗжаCuClЕФДПЖШЮЊ_______ЃЈНсЙћБЃСє3ЮЛгааЇЪ§зжЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЗњЫсЪЧвЛжжШѕЫсЃЌПЩгУРДПЬЪДВЃСЇЁЃ
вбжЊ25ЁцЪБЃКЂйHF(aq)+OH-(aq)=F-(aq)+H2OЃЈ1ЃЉІЄH=-67ЃЎ7kJЁЄmol-1ЃЌЂкH+(aq)+OH-(aq)=H2OЃЈ1ЃЉ ІЄH=-57ЃЎ3kJЁЄmol-1ЁЃдк20mL0ЃЎ1molЁЄL-1ЧтЗњЫсжаМгШыVmL0ЃЎ1molЁЄL-1NaOHШмвКЃЌЯТСагаЙиЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЧтЗњЫсЕФЕчРыЗНГЬЪНМАШШаЇгІПЩБэЪОЮЊЃК HF(aq)![]() F-(aq)+ H+(aq) ІЄH=-10ЃЎ4kJЁЄmol-1
F-(aq)+ H+(aq) ІЄH=-10ЃЎ4kJЁЄmol-1
B. ЕБV=20ЪБЃЌШмвКжаЃКc(OH-)=c(HF)+c(H+)
C. ЕБV=20ЪБЃЌШмвКжаЃКc(F-)<c(Na+)=0ЃЎ1molЁЄL-1
D. ЕБV>0ЪБЃЌШмвКжаПЩФмДцдкЃКc(Na+)>c(F-)>c(OH-)>c(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОнETHЬьЮФбаОПЫљБЈИцЃЌзщГЩЬЋбєЕФЦјЬхжаДцдк20NeКЭ22NeЃЌЯТСаЙигк20NeКЭ22NeЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.20NeКЭ22NeЛЅЮЊЭЌЮЛЫи
B.20NeКЭ22NeЛЅЮЊЭЌЗжвьЙЙЬх
C.20NeКЭ22NeЕФжЪСПЪ§ЯрЭЌ
D.20NeКЭ22NeЕФжазгЪ§ЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭМЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
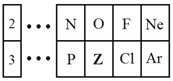
ЃЈ1ЃЉZдЊЫидкдЊЫижмЦкБэжаЮЛгкЕк________зхЁЃ
ЃЈ2ЃЉZЕФдзгАыОЖ__________ЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉSiЕФдзгАыОЖЁЃ
ЃЈ3ЃЉClдЊЫиЕФЗЧН№ЪєадБШZдЊЫиЕФ__________ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
ЃЈ4ЃЉZдЊЫиЕФЦјЬЌЧтЛЏЮяЕФЛЏбЇЪНЮЊ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПN2O5дквЛЖЈЮТЖШЯТПЩЗЂЩњЯТСаЗДгІЃК2N2O5(g)![]() 4NO2(g)ЃЋO2(g) ІЄH>0ЁЃT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЮЊЃК
4NO2(g)ЃЋO2(g) ІЄH>0ЁЃT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЮЊЃК
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
A. 500 sФкN2O5ЗжНтЫйТЪЮЊ2.96ЁС10Ѓ3mol/(LЁЄs)
B. T1ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK1ЃН125ЃЌ1 000 sЪБзЊЛЏТЪЮЊ50%
C. ЦфЫћЬѕМўВЛБфЪБЃЌT2ЮТЖШЯТЗДгІЕН1 000 sЪБВтЕУN2O5(g)ХЈЖШЮЊ2.98 mol/LЃЌдђT1<T2
D. T1ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK1ЃЌT3ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK3ЃЌШєK1>K3ЃЌдђT1>T3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋСНжжВЛЭЌЮяжЪЕФСПХЈЖШЕФNa2CO3ШмвКЩ§ИпЮТЖШШмвКжаc(CO32-)БфЛЏШчЭМЫљЪОЃЌЯТСаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕе§ШЗЕФЪЧЃЈ ЃЉ
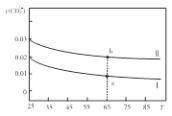
AЃЎНЋШмвКIЩ§ИпЮТЖШЃЌШмвКpHМѕаЁ
BЃЎШмвКaБШШмвКbжа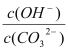 ИќДѓ
ИќДѓ
CЃЎ65ЁцЪБЃЌЯђШмвКaжаМгШы1.06gNa2CO3ЙЬЬхЃЌШмНтКѓМДЮЊШмвКb
DЃЎШмвКIIвЛЖЈДцдкЃКc(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњЪЧИіИжЬњДѓЙњЃЌИжЬњВњСПЮЊЪРНчЕквЛЃЌИпТЏСЖЬњЪЧзюЮЊЦеБщЕФСЖЬњЗНЗЈЁЃ
IЃЎвбжЊЃК2COЃЈgЃЉЃЋO2ЃЈgЃЉЃН2CO2ЃЈgЃЉЁїHЃНЃ566kJ/mol
2FeЃЈsЃЉ+3/2O2ЃЈgЃЉЃНFe2O3ЃЈsЃЉ ЁїHЃНЃ825.5 kJ/mol
дђЗДгІЃКFe2O3ЃЈsЃЉЃЋ3COЃЈgЃЉ![]() 2FeЃЈsЃЉЃЋ3CO2ЃЈgЃЉ ЁїHЃН kJ/molЁЃ
2FeЃЈsЃЉЃЋ3CO2ЃЈgЃЉ ЁїHЃН kJ/molЁЃ
IIЃЎЗДгІ1/3Fe2O3ЃЈsЃЉЃЋCOЃЈgЃЉ![]() 2/3FeЃЈsЃЉЃЋCO2ЃЈgЃЉдк1000ЁцЕФЦНКтГЃЪ§ЕШгк4.0ЁЃдквЛИіШнЛ§ЮЊ10LЕФУмБеШнЦїжаЃЌ1000ЁцЪБМгШыFeЁЂFe2O3ЁЂCOЁЂCO2Иї1.0molЃЌЗДгІОЙ§l0minКѓДяЕНЦНКтЁЃ
2/3FeЃЈsЃЉЃЋCO2ЃЈgЃЉдк1000ЁцЕФЦНКтГЃЪ§ЕШгк4.0ЁЃдквЛИіШнЛ§ЮЊ10LЕФУмБеШнЦїжаЃЌ1000ЁцЪБМгШыFeЁЂFe2O3ЁЂCOЁЂCO2Иї1.0molЃЌЗДгІОЙ§l0minКѓДяЕНЦНКтЁЃ
ЃЈ1ЃЉCOЕФЦНКтзЊЛЏТЪ= _____________ЁЃ
ЃЈ2ЃЉгћЬсИпCOЕФЦНКтзЊЛЏТЪЃЌДйНјFe2O3ЕФзЊЛЏЃЌПЩВЩШЁЕФДыЪЉЪЧ________
aЃЎЬсИпЗДгІЮТЖШ bЃЎдіДѓЗДгІЬхЯЕЕФбЙЧП
cЃЎбЁШЁКЯЪЪЕФДпЛЏМС dЃЎМАЪБЮќЪеЛђвЦГіВПЗжCO2
eЃЎЗлЫщПѓЪЏЃЌЪЙЦфгыЦНКтЛьКЯЦјЬхГфЗжНгДЅ
IIIЃЎИпТЏСЖЬњВњЩњЕФЗЯЦјжаЕФCOПЩНјааЛиЪеЃЌЪЙЦфдквЛЖЈЬѕМўЯТКЭH2ЗДгІжЦБИМзДМЃКCO(g)+ 2H2(g)![]() CH3OH(g)ЁЃЧыИљОнЭМЪОЛиД№ЯТСаЮЪЬтЃК
CH3OH(g)ЁЃЧыИљОнЭМЪОЛиД№ЯТСаЮЪЬтЃК
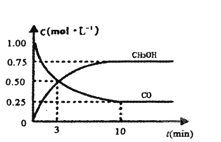
ЃЈ1ЃЉДгЗДгІПЊЪМЕНЦНКтЃЌгУH2ХЈЖШБфЛЏБэЪОЦНОљЗДгІЫйТЪv(H2)=________ЁЃ
ЃЈ2ЃЉШєдквЛЬхЛ§ПЩБфЕФУмБеШнЦїжаГфШыl molCOЁЂ2molH2КЭ1molCH3OHЃЌДяЕНЦНКт МВтЕУЛьКЯЦјЬхЕФУмЖШЪЧЭЌЮТЭЌбЙЯТЦ№ЪМЕФ1.6БЖЃЌдђИУЗДгІЯђ________(ЬюЁАе§ЁБЁЂЁАФцЁБ)ЗДгІЗНЯђвЦЖЏЁЃ
ЃЈ3ЃЉвдМзЭщЮЊШМСЯЕФаТаЭЕчГиЃЌЦфГЩБОДѓДѓЕЭгквдЧтЦјЮЊШМСЯЕФДЋЭГШМСЯЕчГиЃЌФПЧАЕУЕНЙуЗКЕФбаОПЃЌШчЭМЪЧФПЧАбаОПНЯЖрЕФвЛРрЙЬЬхбѕЛЏЮяШМСЯЕчГиЙЄзїдРэЪОвтЭМЁЃЛиД№ЯТСаЮЪЬтЃК
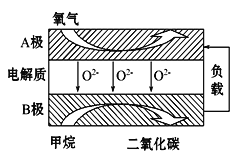
1ЃЉBМЋЩЯЕФЕчМЋЗДгІЪНЮЊ ЁЃ
2ЃЉШєгУИУШМСЯЕчГизіЕчдДЃЌгУЪЏФЋзіЕчМЋЕчНтСђЫсЭШмвКЃЌЕБбєМЋЪеМЏЕН11.2LЃЈБъзМзДПіЃЉЦјЬхЪБЃЌЯћКФМзЭщЕФЬхЛ§ЮЊ LЃЈБъзМзДПіЯТЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЊЫиRЁЂTЁЂXЁЂYЁЂZдкдЊЫижмЦкБэжаЕФЯрЖдЮЛжУШчЯТЭМЫљЪОЃЌЦфжаZЕЅжЪгыH2ЛьКЯгіЧПЙтЛсЗЂЩњБЌеЈЁЃдђЯТСаХаЖЯДэЮѓЕФЪЧ
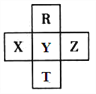
A. дзгАыОЖ ZЃОYЃОR
B. RгыYЕФЕчзгЪ§ЯрВю8
C. ЗЧН№ЪєадЃКZЃОYЃОX
D. HZO4ЪЧФПЧАЮоЛњЫсжазюЧПЕФКЌбѕЫс
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com