
����Ŀ��N2O5��һ���¶��¿ɷ������з�Ӧ��2N2O5(g)![]() 4NO2(g)��O2(g) ��H>0��T1�¶��µIJ���ʵ������Ϊ��
4NO2(g)��O2(g) ��H>0��T1�¶��µIJ���ʵ������Ϊ��
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
����˵������ȷ����( )
A. 500 s��N2O5�ֽ�����Ϊ2.96��10��3mol/(L��s)
B. T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱת����Ϊ50%
C. ������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1>K3����T1>T3
���𰸡�C
�����������������A������ͼ�����ݷ�������500s��N2O5(g)���ĵ�Ũ��=5.00mol/L-3.52mol/L=1.48mol/L���ֽ�����=![]() =2.96��10-3mol/(Ls)����A��ȷ��B���ɱ������ݿ�֪��T1�¶��£�1000sʱ��Ӧ����ƽ�⣬ƽ��ʱc(N2O5)=2.5mol/L��c(NO2)=5mol/L��c(O2)=1.25mol/L��ƽ�ⳣ��K =
=2.96��10-3mol/(Ls)����A��ȷ��B���ɱ������ݿ�֪��T1�¶��£�1000sʱ��Ӧ����ƽ�⣬ƽ��ʱc(N2O5)=2.5mol/L��c(NO2)=5mol/L��c(O2)=1.25mol/L��ƽ�ⳣ��K =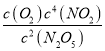 =
=![]() = 125��ת����Ϊ
= 125��ת����Ϊ![]() ��100%=50%����B��ȷ��C���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�ƶ���ƽ��ʱʱN2O5(g)Ũ��Ӧ���ͣ�������������ʱ��T2�¶��·�Ӧ��1000sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L��Ũ�ȴ���2.5mol/L���ʲ�����Ϊ�����¶ȣ�ӦΪ�����¶ȣ���T1��T2����C����D��ƽ�ⳣ��ֻ���¶�Ӱ�죬T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1��K3����Ӧ���ȷ�Ӧ����T1��T3����D��ȷ����ѡC��
��100%=50%����B��ȷ��C���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�ƶ���ƽ��ʱʱN2O5(g)Ũ��Ӧ���ͣ�������������ʱ��T2�¶��·�Ӧ��1000sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L��Ũ�ȴ���2.5mol/L���ʲ�����Ϊ�����¶ȣ�ӦΪ�����¶ȣ���T1��T2����C����D��ƽ�ⳣ��ֻ���¶�Ӱ�죬T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1��K3����Ӧ���ȷ�Ӧ����T1��T3����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������һ�ָ�Ʒ�ʵ�ʳ�����������е���Ҫ�ɷ�����
A. ���� B. ��֬ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.1 mol��L��1�Ĵ�����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
���������ռ���� �������¶� �������������� ����ˮ
A���٢� B���ڢ� C���ۢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3�������������Լ������ﻹԭ�������ȼ��ȡ������ȡ������ֽ⡣���ж����Ʊ������������Ϊ�����ȵ����ƺ��������ƻ��Һ��ͨ��������������������ᾧ���Ƶ���������ƾ��塣�Ʊ������з�������Ҫ��Ӧ���£�
Na2S �� H2O �� SO2 �� Na2SO3 �� H2S �������� ��i��
2H2S �� SO2 �� 3S �� 2H2O ���������������� ��ii��
S �� Na2SO3 ������ Na2S2O3 ����������������iii��
��1����֪Na2S2O3�ֽⷴӦ�����ȷ�Ӧ���ɴ˿ɵó����÷ֽⷴӦ�У���Ӧ����ѻ�ѧ�������յ�������_________������ڡ�����С�ڡ����ڡ����������γɻ�ѧ�����ų�����������
��2��Na2S2O3���л�ԭ�ԣ��ж�������_________��_________������д����������
��3��������Ӧi ~ iii�ܷ�Ӧ�Ļ�ѧ����ʽΪ_________���Ʊ������У���ʹ����Ӧ�����������ѧ����ʽ�ļ�����������ȣ���Ӧ�����Ӧ������ʣ�࣬��˵���ù����д���_________��
��4��Ϊ�˱�֤��������ƵIJ�����������ͨ���SO2���ܹ�����ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������A��B����Ӧ��
A: 2NaOH+H2SO4=Na2SO4+2H2O��B:Zn+H2SO4=ZnSO4+H2��
��A��B��Ӧ����Ƴ�Ϊԭ��ص���____(�A����B��)��
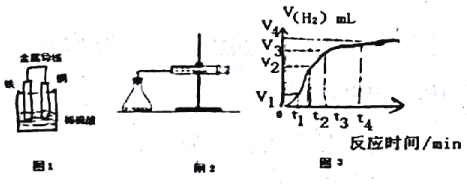
��2��ijԭ���ʾ��ͼ��ͼ1����õ�ظ����缫�ķ�Ӧ����ʽΪ_______________��
��3�����õ�ط�Ӧ�����й���0.3mol���ӷ���ת�ƣ������ɵ���������ڱ�״���µ������_____L��
��4��Ϊ���о�Fe��ϡH2SO4��Ӧ�����ʣ�ijͬѧͨ����ͼ2ʵ��װ�òⶨ��Ӧ�����ɵ�H2�������������ͼ3��ʾ�����ߣ��ڸ�ʵ������з�����ƿ�¶����ߡ���ش��������⡣
��0��tl��tl��t2��t2��t3����ʱ������Ӧ��������ʱ�����____����������������ܵ�ԭ����_____����ʵ��������ռ���������������______ʱ���ڡ�
��5��Ϊ�˼����÷�Ӧ�����ʣ�����Ϊ���еķ�����________��
A����H2SO4��Һ�м�����ˮ B����FeƬ�ij�Fe��
C����H2SO4��Һ�м�Na2SO4��Һ D����H2SO4��Һ�е��뼸��Cu(NO3)2��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ�����������ʵ�飬��ͼ��������ʾ�������й�������ȷ����

A������ͼ����ʾʵ�飬���Ը��ݳ���ʯ��ˮ�Ƿ����Ǽ���̼���ƺ�̼�����ƹ���
B����ͼ����ʾʵ���������ֻ�Թ��м������������ᣬȻ�������������зֱ��������ʵ�����̼���ƺ�̼�����ƹ��壬���ݷ�Ӧ������Ĵ�С�ɼ������ֹ���
C����ʵ������ȣ�ʵ������ͻ���ŵ��ǿ���������һ��װ��ͬʱ���������Ա�ʵ�飬��������
D������ʵ������֤̼���ƺ�̼�����Ƶ��ȶ��ԣ���С�Թ�B��װ��Ĺ�����̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ��Ӧ����ʵ�����������������Ȼ��̵�ʵ�飬�ܴﵽʵ��Ŀ�ĵ����� ��
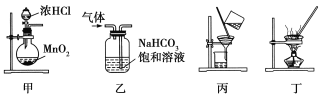
A����װ�ü���ȡ����
B����װ���ҳ�ȥ�����е������Ȼ���
C����װ�ñ�����������̺��Ȼ�����Һ
D����װ�ö������Ȼ�����Һ��MnCl2��4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ͨ��ʵ���ж�A��B��C��������Ļ�ԣ���������ʵ�鲢�ý��ۣ���A��B���ԭ���ʱ��A Ϊ��ص���������B��C���ԭ���ʱ����������Ϊ��B��C���ݴ˿�֪�����ֽ����Ļ��ǿ��˳��Ϊ�� ��
A.A��B��C
B.A��C��B
C.C��B��A
D.B��C��A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ����̼�Ļ���������������������������ء�
(1)��֪��N2(g)��O2(g)===2NO(g)�� ��H����180.5 kJ��mol��1
2H2(g)��O2(g)===2H2O(g)�� ��H����483.6 kJ��mol��1
��Ӧ2H2(g)��2NO(g)===2H2O(g)��N2(g)����H�� ��
(2)��ѹǿΪ0.1 MPa��������CO��H2�Ļ�������ڴ���������ת��Ϊ�״��ķ�ӦΪ
CO(g)��2H2(g) ![]() CH3OH(g) ��H<0
CH3OH(g) ��H<0
��������˵���÷�Ӧ�ﵽƽ��״̬���� ��
a�����������ܶȲ��ٱ仯 b��CO��H2�����ʵ���֮�Ȳ��ٱ仯
c��v(CO)=v(CH3OH) d��CO�ڻ�����е������������ֲ���
��T1��ʱ����һ�����Ϊ5 L�ĺ�ѹ�����г���1 mol CO��2 mol H2������5 min�ﵽƽ�⣬CO��ת����Ϊ0.75����T1��ʱ��CO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ��K= ��
CH3OH(g)��ƽ�ⳣ��K= ��
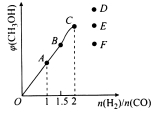
����T1��ʱ�������Ϊ5 L�ĺ��������г���һ������H2��CO����Ӧ�ﵽƽ��ʱCH3OH�����������n(H2)��n(CO)�Ĺ�ϵ��ͼ��ʾ���¶Ȳ��䣬��![]() ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е� �㡣
ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е� �㡣
(3)�ô�ת��װ�þ�������β����װ�����漰�ķ�Ӧ֮һΪ��2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
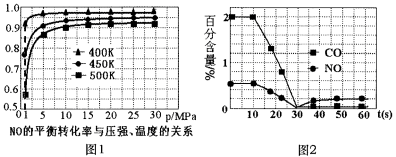
��̽��������Ӧ��NO��ƽ��ת������ѹǿ���¶ȵĹ�ϵ���õ���ͼ1��ʾ�����ߡ���װ�ñȽ��ʺϵ��¶Ⱥ�ѹǿ��___________��
�ڲ���ij�ͺ�������������(������ָ������ˮ�µ͵����������)ʱ��װ����CO��NO�ٷֺ�����ʱ��仯������ͼ2��ʾ����ǰ10 s�ڣ�CO��NO�ٷֺ���û���Ա仯��ԭ����____________��
(4)��ͼ��ʾ��װ�������պ�ת��NO2��SO2��
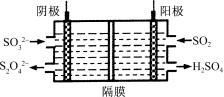
���������ĵ缫��ӦʽΪ ��
�������ų�����Һ�к�S2O![]() ���ӣ��ܽ�NO2����ת��Ϊ����Ⱦ���壬ͬʱ���ɵ�SO
���ӣ��ܽ�NO2����ת��Ϊ����Ⱦ���壬ͬʱ���ɵ�SO![]() ����������������д���÷�Ӧ�����ӷ���ʽ�� ��
����������������д���÷�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com