
下列说法中正确的是
A.航天飞机上的隔热陶瓷瓦属于优质合金材料
B.将少量CO2通入CaCl2溶液能生成白色沉淀
C.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
科目:高中化学 来源:2013-2014山东省菏泽市高二上学期期末13校联考化学B试卷(解析版) 题型:填空题
(8分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,
 请回答:
请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为_______(用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省增城市高一上学期期末化学试卷(解析版) 题型:选择题
绿色植物是空气天然的“净化器”,研究发现,1亩柳杉每天可以吸收5mol SO2。则1亩柳杉每天吸收的SO2的质量为
A.320g B.160g C.64g D.32g
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
下图装置中,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是

A.若a为NO,b为NaOH溶液,可出现无色喷泉
B.若a为HCl,b为AgNO3溶液,可出现白色喷泉
C.若a为CO2,b为NaOH溶液,可出现无色喷泉
D.若a为NH3,b为水(预先滴入少量酚酞溶液),可出现红色喷泉
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列变化只需通过一步化合反应就可以实现的是
A.FeCl3→FeCl2 B.Al2O3→Al(OH)3
C.SiO2→H2SiO3 D.S→SO3
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用不正确的是
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.生石灰能与水反应,可用来干燥氯气
C.维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好
D.氮气的化学性质不活泼,可用作粮食和食品仓库的保护气
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:填空题
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间满碎塑料泡沫的作用是______________________________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,溶液温度升高度数________(填“相等”或“不相等”)。所求中和热的数值会________(填“相等”或“不相等”),理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用铜作阳极 D.电解食盐水时铜作阳极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省七校联盟高三第一次联考理综化学试卷(解析版) 题型:填空题
【化学-选修2:化学与技术】(15分)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
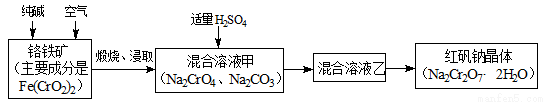
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是___。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的是__________________________________________。
②混合溶液乙中溶质的化学式是_________________________________________________。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com