
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.CO2 | B.NH3 | C.NO2 | D.Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
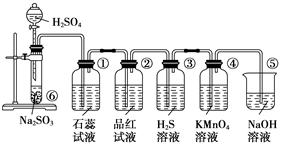 [
[查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
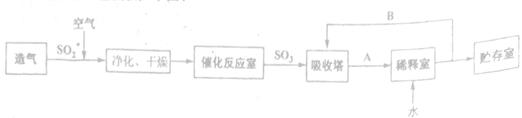
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
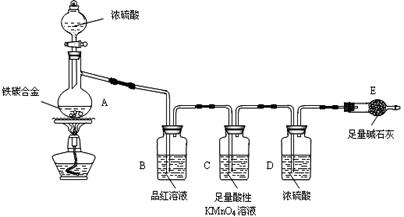
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B.由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 |
| C.稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 |
| D.浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com