
【题目】下列与实验现象对应的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向浓度为0.1mol/LNaCl、KI混合液中逐滴加入AgNO3溶液 | 出现黄色沉淀 | 溶解性:AgCl>AgI |
B | 溴乙烷与NaOH的乙醇溶液共热,将溢出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中有NH4+ |
D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
A.AB.BC.CD.D
【答案】A
【解析】
A.沉淀可以转化为溶解度更小的沉淀,向浓度为![]() 、KI混合液中逐滴加入
、KI混合液中逐滴加入![]() 溶液,先出现黄色沉淀,说明碘化银溶解度比氯化银小,故A正确;
溶液,先出现黄色沉淀,说明碘化银溶解度比氯化银小,故A正确;
B.溴乙烷与NaOH的乙醇溶液共热发生消去反应生成乙烯,乙醇易挥发,与乙烯气体一起逸出,乙醇也能够被高锰酸钾氧化,使高锰酸钾褪色,所以不能排除乙醇的干扰,故B错误;
C.氨根离子检验应向溶液中加入浓氢氧化钠,一般需要加热,然后将湿润的红色石蕊试纸置于管口,若变蓝证明有氨气产生,原溶液中存在氨根离子,而操作中使用的是干燥的红色石蕊试纸,遇氨气不会变蓝,不能证明是否含有NH4+,故C错误;
D.将![]() 气体通入
气体通入![]() 溶液,
溶液,![]() 与水作用会形成酸性溶液,酸性条件下硝酸根具有强氧化性,发生氧化还原反应生成硫酸钡沉淀,故D错误;
与水作用会形成酸性溶液,酸性条件下硝酸根具有强氧化性,发生氧化还原反应生成硫酸钡沉淀,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列实验操作能得出相应结论的是
选项 | 实验操作或现象 | 实验结论 |
A | 在含 NaOH 的 Mg(OH)2 悬浊液中滴加 CoCl2 溶液,产生粉红色沉淀 | Ksp[Co(OH)2]<Ksp[Mg(OH)2] |
B | 在透明溶液中通入 CO2,产生白色胶状沉淀 | 原溶液中一定含有 SiO32- |
C | 在新制氯水中加入碳酸钙粉末,搅拌,过滤 | 氯水的漂白性会增强 |
D | 将 Fe 粉、Cu 粉分别与硫粉混合加热,分别生成 FeS、Cu2S | 还原性:Fe>Cu |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g)![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_______________________________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3v正(H2)=v逆(CH4)
E.混合气体的平均相对分子质量不变
(3)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100kPa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。

①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是______________________________;________点对应的压强最大。
②300℃,100kPa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
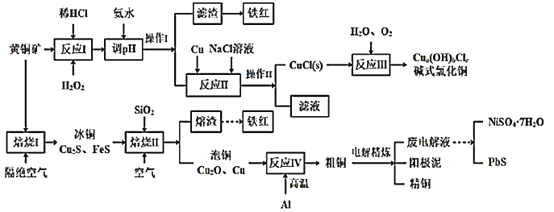
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
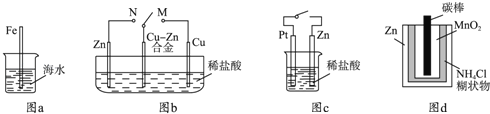
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸H2A溶液,按下式发生电离:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-,下列四种溶液中c(A2-)最大的是( )
H++A2-,下列四种溶液中c(A2-)最大的是( )
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是( )
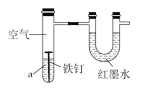
A. 铁钉表面发生的反应为Fe-3e-=Fe3+
B. 若液体a为稀醋酸,则U形管液面右高左低
C. 若液体a为食盐水,则U形管液面左高右低
D. 若液体a为食用油,则铁钉生锈速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是( )
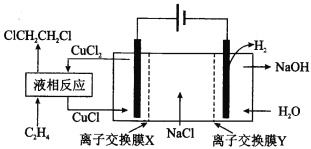
A.该装置工作时,阴极区溶液中的离子浓度不断增大
B.液相反应中,C2H4被CuCl2氧化为1,2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+2H2O+2NaCl![]() H2↑+2NaOH+ClCH2CH2Cl
H2↑+2NaOH+ClCH2CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com