
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→ →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
|
实验编号 |
NaOH溶液的浓度(mol/L) |
滴定完成时, NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约 (保留两位有效数字)。
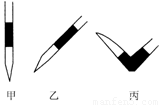
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 (选择甲、乙、丙之一),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有: 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外。
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)①定容 ②0.4 烧杯(或表面皿)药匙
(2)①最后一滴NaOH溶液加入,溶液由无色恰好变成粉红色 ②0.11 mol/L ③丙 ④ DE
【解析】
试题分析:试题分析:(1)①配制一定体积一定物质的量浓度的溶液的操作步骤是计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→ 摇匀→ 装瓶 →贴签。②n(NaOH)= 0.100 L ×0.10 mol/L=0.01mol.m(NaOH)=0.01mol×40g/mol=0.4g.因此要称量0.4gNaOH. 所需仪器有:天平(带砝码、镊子)\烧杯、药匙。(2)①由于是用已知浓度的碱滴定未知浓度的酸,所以指示剂在酸溶液中,当滴定达到终点时会看到溶液由无色变为红色,且半分钟内不褪色即可确定滴定达到了终点。②V(NaOH)= (22.62+22.72+22.80)ml÷3=22.71ml.因为HCl恰好反应时物质的量的比为1:1.所以c(HCl)= ( 0.10 mol/L×22.71ml)÷20.00ml= 0.11 mol/L. ③ 排去碱式滴定管中气泡的方法应采用如图所示操作中的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。④A.滴定终点读数时俯视读数,读数偏小,则溶液的体积就偏小。计算出待测溶液的浓度就偏低。错误。B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗。则待测盐酸溶液的物质的量就偏少,滴定时消耗的标准溶液的体积偏小,计算出待测溶液的浓度就偏低。错误。C.锥形瓶水洗后未干燥。不会影响实验测定结果。错误。D.滴定过程中,有少量标准液溅出锥形瓶外。为了将待测溶液进行滴定,就要多滴加标准溶液,标准溶液体积偏大,由此计算出待测溶液的浓度就偏高。正确。E.碱式滴定管尖嘴部分有气泡,滴定后消失。开始读数偏小,后来读数偏小,则消耗的标准溶液的体积就偏多,由此计算出待测溶液的浓度就偏高。正确。
考点:考查酸碱中和滴定的操作步骤、滴定终点的判断、浓度的计算及实验误差分析的知识。


科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.1000 | 22.62 | 20.00 |
| 2 | 0.1000 | 22.72 | 20.00 |
| 3 | 0.1000 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二第二次阶段考试化学试卷(解析版) 题型:实验题
(13分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
20.02 |
20.00 |
|
2 |
0.10 |
20.00 |
20.00 |
|
3 |
0.10 |
19.00 |
20.00 |
|
4 |
0.10 |
19.98 |
20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是_______________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com