
分析 (1)在原子中,核电荷数=质子数=核外电子数,质量数=质子数+中子数;
(2)在阳离子中,核电荷数=质子数=核外电子数+所带电荷数;
(3)在阴离子中,核电荷数=质子数=核外电子数-所带电荷数;
(4)在原子中,核电荷数=质子数=核外电子数,中子数=质量数-质子数,分子的中子数等于各原子的中子数之和;
(5)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,计算出n克A2-离子的物质的量,则可计算电子个数.
解答 解:(1)根据在原子中:元素符号左上角数字为质量数,左下角数字为质子数,质量数=质子数+中子数,所以${\;}_{Z}^{A}$X中子数=质量数-质子数=A-Z,
故答案为:A-Z;
(2)根据在阳离子中:核电荷数=质子数=核外电子数+所带电荷数,即阳离子AXn+核电荷数=质子数=x+n,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x+n),
故答案为:A-x-n;
(3)根据在阴离子中:核电荷数=质子数=核外电子数-所带电荷数,即AXn-核电荷数=质子数=x-n,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x-n),
故答案为:A-x+n;
(4)根据12C中核电荷数=质子数=核外电子数=6,再根据中子数=质量数-质子数=12-6=6,18O中核电荷数=质子数=核外电子数=8,再根据中子数=质量数-质子数=18-8=10,所以12C18O2分子中,中子数N=6+10×2=26,
故答案为:26;
(5)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,n g A2-物质的量n(A2-)=$\frac{n}{m}$mol,
则n克A2-离子中包含电子个数是$\frac{n}{m}$mol×(m-x+2)×NA/mol=$\frac{n}{m}$(m-x+2)mol,
故答案为:$\frac{n}{m}$(m-x+2).
点评 本题考查了原子的构成、物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握原子结构特点以及相关计算公式的运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
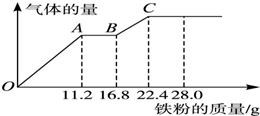 某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硝酸代替浓硝酸与铜反应 | |
| B. | 将煤块粉碎后燃烧 | |
| C. | 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 | |
| D. | 用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(A)=0.09mol•L-1•s-1 | B. | v(B)=0.06mol•L-1•s-1 | ||
| C. | v(C)=0.9mol•L-1•min-1 | D. | v(D)=3.6mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+8 | B. | n+16 | C. | n+18 | D. | n+32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| B. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 2.24LNH3和CH4的混合气体,所含电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-2m | B. | 2m-n | C. | 8+n-2m | D. | 2m-n-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com