
| A. | n+8 | B. | n+16 | C. | n+18 | D. | n+32 |
分析 由元素周期表结构可知,对于处于ⅠA、ⅡA元素而言,同主族相邻元素的原子序数差值为周期数小的元素所在周期含有的元素种数;对于过渡元素后边的所有各主族(包括零族),同主族相邻元素的原子序数差值为周期数大的元素所在周期含有的元素种数.
解答 解:由元素周期表结构可知,从第一周期到第六周期,每周期含有的元素种数分别为2、8、8、18、18、32,第七周期为排满,若排满也是32种,同主族相邻元素的原子序数差值只能为2、8、18、32等,不可能相差16,
故选B.
点评 本题考查学生元素周期表的结构知识,难度不大,熟练掌握元素周期表的结构,理解同主族相邻元素原子序数关系,注意同周期ⅡA族、ⅢA族原子序数关系.


科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
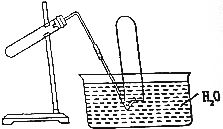
| A. | MnO2与H2O2溶液反应制O2 | B. | Cu与稀硝酸反应制NO | ||
| C. | 加热氯化铵与消石灰制备NH3 | D. | 用Cu于浓硝酸反应制得NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
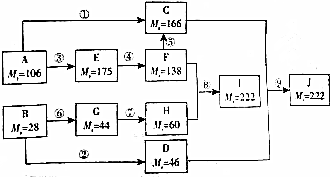
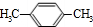 ,BCH2=CH2.
,BCH2=CH2.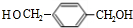 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$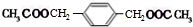 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-═PbSO4+2H2O | |
| B. | 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-═Pb+SO42- | |
| C. | 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 | |
| D. | 充电时可直接使用交流电源,不需要充电器也可充入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
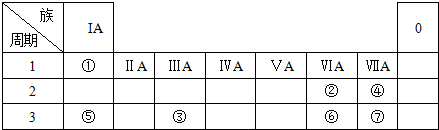
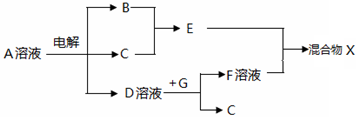
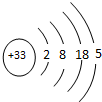 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com