
【题目】环丙叉环丙烷(A)的结构特殊,根据如下转化判断下列说法正确的是( )
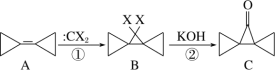
A.反应①、②分别是加成反应和消去反应
B.有机物A 的二氯代物有 4 种(不考虑立体异构)
C.有机物 B 的所有原子都在一个平面内
D.有机物C 的同分异构体中,同时含有苯环和羟基的有 5 种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.肉桂醛和苯甲醛都能发生加成反应、取代反应
B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C.肉桂醛和苯甲醛互为同系物
D.苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法错误的是
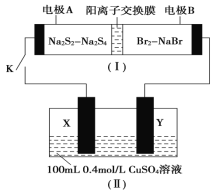
A.闭合开关K时,电极B为正极,且电极反应式为Br2+2e-===2Br-
B.装置(Ⅰ)充电时,Na+从左到右通过阳离子交换膜
C.装置(Ⅰ)放电时,总反应为2Na2S2+Br2===Na2S4+2NaBr
D.该装置电路中有0.1mole-通过时,电极X理论上析出2.56gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,在元素周期表中,A的原子半径最小,B的族序数是其所在周期序数的2倍,D是地壳中含量最多的元素,在元素周期表中A和E同主族。试回答下列问题:
(1)化合物![]() 的电子式为______。
的电子式为______。
(2)化合物![]() 的电子式为______。
的电子式为______。
(3)C的简单氢化物与C的最高价氧化物对应水化物反应生成的盐的化学式为______。
(4)将物质的量之比为1:1的![]() 和
和![]() 组成的混合气体通入到a mol的过量固体
组成的混合气体通入到a mol的过量固体![]() 中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。
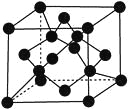
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用g/cm3来表示(即1cm3血样中含有的Ca2+的质量)。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。
某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(步骤1:配制KMnO4标准溶液)
如图是配制100mLKMnO4标准溶液的过程示意图。
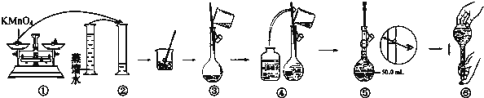
(1)请你观察图示判断,其中不正确的两项操作有___(填序号);
(2)其中确定100mL溶液体积的仪器是____。
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将___(填“偏大”或“偏小”)。
(步骤2:测定血液样品中Ca2+的浓度)
抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(4)写出草酸与酸性KMnO4溶液反应的离子方程式____。
(5)滴定的终点为____。
(6)经过计算,血液样品中Ca2+的浓度为____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(A1N)是一种新型无机非金属材料。某A1N样品仅含有Al2O3杂质,为测定A1N的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案一)
取一定量的样品,用以下装置测定样品中A1N的纯度(夹持装置已略去)。
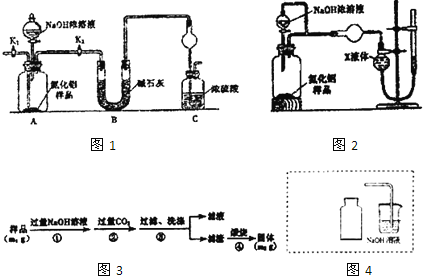
(1)如图1C装置中球形干燥管的作用是___。
(2)完成以下实验步骤:组装好实验装置,首先___再加入实验药品。接下来的实验操作是___,打开分液漏斗活塞,加入浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的是___。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____。
(方案二)
用如图2装置测定mg样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是___。
a.CCl4 b.H2O c.NH4Cl溶液 d.苯
(5)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数____。
(方案三)
按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为____。
(7)若在步骤③中未洗涤,测定结果将___(填“偏高”“偏低’或“无影响”)。
(8)实验室制取NO2气体。在如图4虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物
五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物![]() 是水煤气的主要成分之一,下列说法不正确的是
是水煤气的主要成分之一,下列说法不正确的是
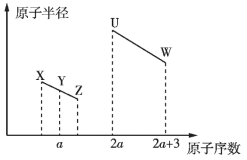
A.![]() 与氢氧化钠溶液反应可能生成酸式盐
与氢氧化钠溶液反应可能生成酸式盐
B.![]() 与
与![]() 形成的化合物中含有离子键
形成的化合物中含有离子键
C.![]() 、
、![]() 、
、![]() 元素的最高价氧化物对应水化物的酸性依次增强
元素的最高价氧化物对应水化物的酸性依次增强
D.若元素![]() 的原子序数大于
的原子序数大于![]() 且与
且与![]() 同主族,则
同主族,则![]() 的金属性强于
的金属性强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com