
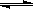 CH3OH��g����H
CH3OH��g����H| �¶� | 250��C | 300��C | 350��C |
| K | 2��041 | 0��270 | 0��012 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ�� ʱ�� ���� | CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
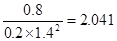 ������¶���250�档
������¶���250�档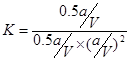 ��V2/a2�������������Ũ�ȣ�ƽ�����淴Ӧ������С�amol�״��൱��a mol CO�� 2a mol H2�����൱��ѹ�������ݻ���ѹǿ�����ٴ�ƽ��ʱCO�ĺ���Ӧ���ǽ��͵ġ�
��V2/a2�������������Ũ�ȣ�ƽ�����淴Ӧ������С�amol�״��൱��a mol CO�� 2a mol H2�����൱��ѹ�������ݻ���ѹǿ�����ٴ�ƽ��ʱCO�ĺ���Ӧ���ǽ��͵ġ�

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ��ֵ�ֱ�Ϊ��
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ��ֵ�ֱ�Ϊ��| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
 CO2(g)��H2(g)
CO2(g)��H2(g)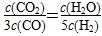 ���жϴ�ʱ���¶���1000 ��
���жϴ�ʱ���¶���1000 ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �� �� | A | B | C |
| ��ʼŨ��/mol��L-1 | 1.0 | 2.0 | 0 |
| 2minʱ��ƽ��Ũ��/mol��L-1 | 0.4 | 0.2 | 1.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3������ƽ���B������SO2���������� ��� >������ < ����=���� A ������SO2����������
2SO3������ƽ���B������SO2���������� ��� >������ < ����=���� A ������SO2����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
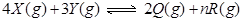 ����ƽ����������¶Ȳ��䣬ƽ���ѹǿ��ԭ������5����X��Ũ�ȼ�С����÷�Ӧ����ʽ�е�nֵ�ǣ� ��
����ƽ����������¶Ȳ��䣬ƽ���ѹǿ��ԭ������5����X��Ũ�ȼ�С����÷�Ӧ����ʽ�е�nֵ�ǣ� ��| A��3 | B��4 | C��5 | D��6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 a Z(g) + W(g) ��H =��QkJ��mol��1 (Q>0)
a Z(g) + W(g) ��H =��QkJ��mol��1 (Q>0)| A��2 molX��1mol Y��1molAr | B��a molZ��1mol W |
| C��1 molX��0.5mol Y��0.5a molZ��0.5 mol W | D��4 molX��2mol Y |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2 Q(g) + n R(g),�ﵽƽ����������¶Ȳ��䣬��������ѹǿ��ԭ������5%��X��Ũ�ȼ�С33.3%����÷�Ӧ����ʽ��nֵ��( )
2 Q(g) + n R(g),�ﵽƽ����������¶Ȳ��䣬��������ѹǿ��ԭ������5%��X��Ũ�ȼ�С33.3%����÷�Ӧ����ʽ��nֵ��( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
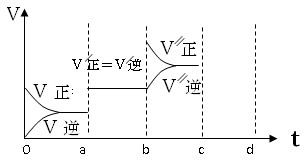
 2HI(g) ��H����26.5 kJ��mol��1����ø����ʵ����ʵ���Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
2HI(g) ��H����26.5 kJ��mol��1����ø����ʵ����ʵ���Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��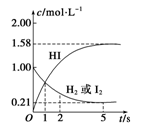
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
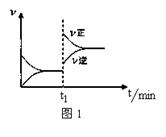
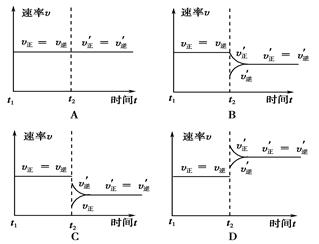
A��2SO2(g)+O2(g) 2SO3(g)�� ��H<0��t1ʱ�������¶� 2SO3(g)�� ��H<0��t1ʱ�������¶� |
B��4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ��H<0��t1ʱ������O2Ũ�� 4NO(g)+6H2O(g) ��H<0��t1ʱ������O2Ũ�� |
C��H2O(g)+CO(g)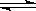 H2(g)+CO2(g) ��H>0�� t1ʱ������ѹǿ H2(g)+CO2(g) ��H>0�� t1ʱ������ѹǿ |
D��C(s)+H2O(g)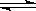 CO(g)+H2(g) ��H>0��t1ʱ�������¶� CO(g)+H2(g) ��H>0��t1ʱ�������¶� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com