
【题目】只用下列试剂中的一种就能将FeCl3、CuCl2、MgCl2和NaCl四种溶液区别开的是 ( )
A. H2SO4溶液 B. BaCl2溶液 C. NaOH溶液 D. AgNO3溶液
科目:高中化学 来源: 题型:
【题目】取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液中的c(OH-)=0.01 mol/L,则原溶液的浓度为( )
A.0.01 mol/LB.0.017 mol/LC.0.05 mol/LD.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
A. 硫钠电池放电时负极反应为:Na-e-=Na+
B. 硫钠电池充电时,每生成1molNa转移xmol电子
C. 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D. 合成氨过程中H+经质子交换膜由a极向b极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数随pH变化的关系如图所示.下列表述正确的是( )
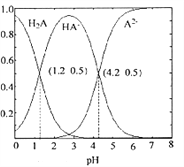
A. 在含H2A、HA-、A2-的溶液中,通入少量HCl,HA-的物质的量分数一定变大
B. 将等物质的量的NaHA、Na2A溶于水中,所得溶液中存在:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
C. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
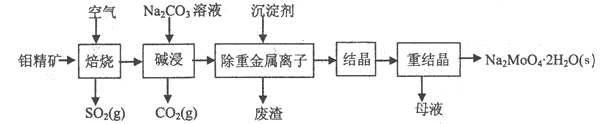
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
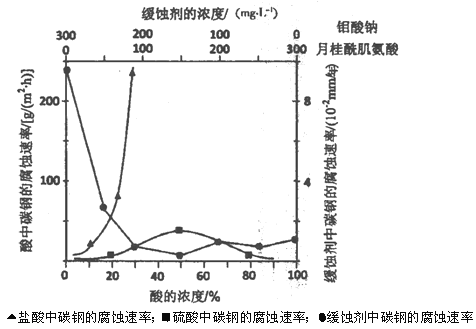
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国决定2011年为国际化学年,旨在纪念化学学科取得的成就及对人类的巨大贡献。下列科学家取得的成就与化学学科研究领域无关的是( )
A.哈伯发明合成氨技术B.门捷列夫发现元素周期律
C.爱因斯坦提出相对论D.居里夫人发现镭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅的化合物的叙述中,正确的是( )
A. 硅是光导纤维的主要成分 B. 硅是构成岩石与许多矿物的基本元素
C. SiO2是酸性氧化物,不与任何酸发生反应 D. 可以通过SiO2一步制得硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)=![]() N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g)![]() SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。

(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com